
پیش بینی جهت پیشرفت واکنش به کمک مقایسه Q و K
برای پیش بینی جهت پیشرفت واکنش در مسیر رفت یا برگشت معیاری با عنوان خارج قسمت واکنش مطرح می شود. در اینجا ابتدا به معرفی این معیار پرداخته و نشان می دهیم چگونه می توان با مقایسه خارج قسمت واکنش و مقدار عددی ثابت تعادل مسیر انجام واکنش را پیش بینی کرد.

خارج قسمت واکنش Q :
در صورتی که قبل از برقراری تعادل، هم واکنش دهنده و هم فراورده در ظرف وجود داشته باشند، از همان ابتدا واکنش رفت و واکنش برگشت انجام می شوند. در این موارد برای این که تشخیص دهیم واکنش در جهت رفت پیش می رود یا در جهت برگشت، ابتدا باید خارج قسمت واکنش (Q) را حساب کنیم. وقتی غلظت واکنش دهنده ها و فراورده ها را در عبارت ثابت تعادل قرار دهیم، آنچه به دست می آید، خارج قسمت واکنش نام دارد. برای واکنش کلی زیر داریم:
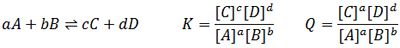
همانطور که می بینید ثابت تعادل (K) و خارج قسمت واکنش (Q) از نظر ظاهری شبیه یکدیگر هستند اما تفاوت مهم آنها این است که در خارج قسمت واکنش (Q) غلظت هایی که قرار می دهیم می توانند غلظت های تعادلی یا غلظت مواد قبل از برقراری تعادل باشند، در حالی که در رابطه ثابت تعادل (K) فقط باید غلظت های تعادلی را قرار دهیم. به عبارتی می توان گفت ثابت تعادل (K) حالت ویژه ای از خارج قسمت واکنش (Q) است.
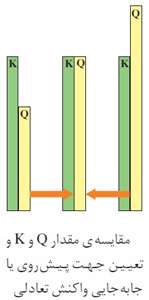
مقایسه Q و K :
خارج قسمت واکنش، معیاری برای تعیین جهت پیش رفت واکنش است، بدین ترتیب که:
تذکر: Q می تواند صفر تا بی نهایت باشد اما K نمی تواند، زیرا K مربوط به حالت تعادل بوده و در حالت تعادل غلظت هیچ ماده ای صفر نیست.
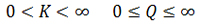
دو نکته مهم:
- هنگامی که می گوییم تعادل در سمت چپ قرار دارد بدین معنی است که مقدار K کوچک است. چون در این حالت تنها می توان دریافت که مقدار K از یک کوچکتر بوده اما نمی توان Q و K را با هم مقایسه نمود.
- هنگامی که می گوییم تعادل به سمت چپ می رود بدین معنی که Q>K است. چون در این حالت مقدار عددی K معلوم نیست ولی K هرچه باشد از Q کوچکتر است.

















