دانستنی های علمی
اطلاعات اولیه
| |
| نام آیوپاک | نامهای دیگر | فرمول شیمیایی | وزن مولکولی | نقطه جوش | نقطه ذوب | PH |
| اتانول | اتیل الکل ، الکل اتیلیک | 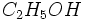 | 46.069gr/mol | 78.4 درجه سانتیگراد | 114.3- درجه سانتیگراد | 7 |
 |
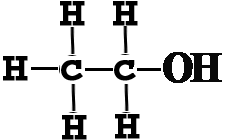
| ساختمان اتانول |
تاریخچه
اتانول برای انسان از دوران باستان شناخته شده بود، زیرا این ماده ، جزء اصلی مشروبات الکلی است. جداسازی آن بصورت اتانول نسبتا خالص احتمالا اولین بار توسط "
جابر بن حیان" که صنعت تقطیر را گسترش داد، انجام شده است. البته بیشتر گمان میرود که اتانول خالص توسط "
محمد زکریای رازی" دانشمند ایرانی تولید شده باشد.
فرایند تولید
اتانول مورد استفاده در نوشابههای الکلی توسط فرایند تخمیر از متابولیسم گلوکز توسط گونه مخصوصی از مخمرها در غیاب اکسیژن تولید میشود و در پایان فرایند تخمیر غلظت اتانول را با تقطیر بالا میبرند. برای مخلوط اتانول با آب بالاترین نقطه آزئوتروپ جوش برای 95% الکل و 5% آب است. بنابراین جزء تقطیر شده مخلوط اتانول و آب نمیتواند خالصتر از 95 درصد باشد. برای تولید اتانول خالصتر ، مقدار کمی بنزن به آن اضافه میشود.
بنزن ، آزئوتروپ سهگانه ای با آب و اتانول تشکیل میدهد و مخلوط دوباره تقطیر میشود. نتیجه این فرایند بدست آوردن اتانول بدون آب است. با این همه چند ppm بنزن در اتانول باقی میماند که جذب آن در بدن از مشخصههای آسیب کبدی است که در افراد الکلی دیده میشود.
تولید اتانول صنعتی
اتانول سوخت نسبتا خوبی برای موتورهاست و در صنعت ، بصورتهای مختلفی استفاده میشود. اتانول مورد مصرف در صنعت را معمولا از واکنش کاتالیزوری آب با اتیلن تولید میکنند. این یک واکنش افزایشی است که در آن یک مولکول آب شکافته شده ، قطعات حاصل از آن به اتمهای کربن در پیوند دوگانه اضافه میشود. این فرایند ، تولید اتانول اقتصادیتر از تولید آن با مخمر است.
امروزه برای تولید تجارتی آسان آن تخمیر مواد آلی زائد مانند خرده چوب و خاک اره پیشنهاد شده است. اتانول صنعتی برای مصرف انسان ، نامناسب است، زیرا به آن ، مقادیر کمی متانول و مواد سمی دیگر اضافه میشود.
خواص فیزیکی
اتانول ، مایعی قابل احتراق و بیرنگ بوده ، یکی از انواع الکلهای موجود در نوشابههای الکلی است.
گرانروی آن ، مانند آب است و بوی نسبتا تندی دارد. در صنعت بعنوان حلال و ماده واسطه شیمیایی برای تولید بیشتر ترکیبات آلی استفاده میشود. بدلیل تشکیل پیوند هیدروژنی با هر نسبتی در آب حل میشود. اتانول در مقایسه با ترکیبات آلی که وزن مولکولی یکسانی با آن دارند،
نقطه جوش بالاتری دارد.
به عنوان مثال نقطه جوش پروپان که تقریبا وزن مولکولی برابری با اتانول دارد، 43- درجه سانتیگراد است، درحالیکه نقطه جوش اتانول 78 درجه سانتیگراد است. دلیل این اختلاف ، وجود پیوندهای هیدروژنی مربوط به گروه
OH است که نیروی جاذبه میان مولکولهای مجاور را افزایش میدهد. اتانول خاصیت ضعیف اسیدی و بازی از خود نشان میدهد که خاصیت بازی آن بدلیل جفت الکترون تنهای اکسیژن بوده و خاصیت اسیدی آن ، بخاطر پیوند هیدروژن با عنصر الکترونگاتیو اکسیژن است. اتانول با فلزات فعال ( Na و K و Mg و … ) وارد واکنش شده ،
اتوکسید ایجاد میکند.
کاربرد
اتانول بدلیل نقطه ذوب پائین در صنعت ضدیخسازی استفاده میشود. حلال بسیار خوبی است و در صنعت عطرسازی ، رنگسازی و … استفاده میشود. محلول %85 – 70 آن بعنوان محلول ضدعفونی کننده کاربرد دارد. اتانول با تغییر دادن پروتئین و حل کردن چربی ، میکرو ارگانیسمهای آنها را از بین میبرد. البته این عمل فقط در برابر باکتریها و ویروسها و قارچها موثر است، ولی در مقابل هاگ ، باکتریها تاثیری ندارد. اتانول همچنین در صنایع مشروبات الکلی به میزان گسترده ای مورد استفاده قرار میگیرد.
 |
| ساختمان اتانول |
نکته مهم
مصرف بیش از حد مشروبات الکلی ، بدلیل وجود اتانول در ترکیب آنها باعث ایجاد عوارض بسیاری در سلامتی انسان میشود که عبارتند از :
عوارض حاد
تهوع ، استفراغ ، افسردگی ، تنگی نفس.
عوارض مزمن
اعتیاد به الکل (الکسیم) ، سایروز کبدی ، تاثیر در سلسله
اعصاب مرکزی ، تاثیر در
حافظه در بلند مدت.
دوشنبه 29/10/1393 - 11:15
دانستنی های علمی

دید کلی
الکلها ، موادی اینچنین مهم در شیمی آلیفاتیک ، نهتنها باید از نظر واکنشها بسیار گوناگون و تنوعپذیر باشند، بلکه به مقدار زیاد و با قیمت ارزان نیز باید قابل تهیه باشند. برای بدست آوردن الکلهای سبک که تکیهگاه سنتز آلی آلیفاتیک هستند، سه روش اصلی وجود دارد، روشهایی که میتوانند همه منابع مواد آلی را مورد استفاده قرار دهند؛ نفت ، گاز طبیعی ، زغال سنگ و
زیست توده. این سه روش عبارتند از:
- آبدار کردن آلکنهای بدست آمده از کراکینگ نفت
- فرایند اکسو از آلکنها ، منوکسید کربن ، هیدروژن
- تخمیر کربوهیدراتها
علاوه بر این سه روش اصلی ، روشهای دیگری نیز با کاربرد محدود وجود دارند. بهعنوان مثال ، متانول از هیدروژندار کربن کاتالیزوری منوکسید کربن بدست میآید. مخلوط هیدروژن و منوکسید کربن با نسبت ضروری ، از واکنش آب با متان ، آلکانهای دیگر یا زغال سنگ در دمای بالا بدست میآید. خوبست در این مقاله به بعضی از منابع صنعتی الکلها نگاهی داشته باشیم.
تخمیر کربوهیدراتها
تخمیر قندها با
مخمر ، قدیمیترین فرایند شیمیایی مورد استفاده بشر ، هنوز هم برای تهیه اتانول و بعضی الکلهای دیگر دارای اهمیت بسیار زیادی است. قند مورد نیاز از منابع مختلف تامین میشود، از جمله ملاس حاصل از چغندر قند و نیشکر یا نیشکر بدست امده از انواع غلات. نام الکل غلهای ، به همین دلیل به اتانول داده شده است. اگر در تخمیر ، نشاسته ماده اولیه باشد، علاوه بر اتانول ، مقدار کمی روغن فوزل ، مخلوطی از الکلهای نوع اول ، نیز بدست میآید: عمدتا ایزوپنتیل الکل با مقدار کمی n-پروپیل الکل ، ایزوبوتیل الکل و 2-متیل-1- بوتانول که با عنوان آمیل الکل فعال معروف است.
بدون تردید در آینده ، انسان به کربوهیدراتها بهعنوان منبع کربن ، روی خواهد آورد. کربن برای مواد شیمیایی آلی و کربن بهصورت سوخت. با این گرایش ، فرایندهای تخمیر ، روز بهروز مهمتر و مهمتر خواهند بود.
تهیه اتانول در صنعت
اتانول ، نه فقط قدیمی ترین ماده شیمیایی آلی مورد استفاده انسان است، بلکه یکی از مهمترین مواد آلی نیز هست. در صنعت ، در سطح وسیعی ، از اتانول بهعنوان حلال برای انواع الکلها ، جلاها ، عطرها و مواد خوشطعمکننده ، بهعنوان محیط برای انجام واکنشهای شیمیایی و در
تبلور استفاده میشود. بهعلاوه ، اتانول ، ماده اولیه مهمی در سنتز است.
پس از فراگرفتن مطالب بیشتری درباره واکنشهای اتانول ، بهتر میتوانیم نقش این عضو مهم از خانواده الکلها را ارزیابی کنیم. برای اینگونه مصارف صنعتی ، اتانول را یا از طریق آبدهی به اتیلن و یا تخمیر قند ملاسها ( یا گاهی نشاسته ) تهیه میکنند. بنابراین ، منابع غایی الکل اتیلیک ، نفت ، نیشکر و چغندرقند و انواع غلات است.
اتانول ، الکل موجود در نوشیدنیهای الکلی نیز هست. این نوع الکل را از تخمیر قند منابع گیاهی بسیار متنوعی تهیه میکنند. نوع نوشیدنی حاصل به ماده تخمیر شده ( چاودار یا ذرت ، انگور یا اقطی ، خمیر کاکتوس یا قاصدکها ) ، چگونگی تخمیر (مثلا با خروج دیاکسید یا بدون امکان خروج کربن دیاکسید) و اعمال بعد از تخمیر (تقطیر شد یا نشود) ، بستگی دارد.
دوشنبه 29/10/1393 - 11:15
دانستنی های علمی
| الکلها ترکیباتی هستند که دارای گروه هیدروکسیل میباشند. فرمول کلی آنها ROH است که در آن R یک گروه آلکیل یا آلکیل استخلاف شده است. |

دید کلی
اگر ، بعنوان یک شیمیدان آلی ، قرار بود ده
ترکیب آلیفاتیک انتخاب کنید و سپس در جزیرهای رها شوید، شما قطعا
الکلها را برمیگزیدید. شما میتوانید از آنها تقریبا هر ترکیب آلی دیگر را بسازید، آلکیل هالیدها ،
آلکنها ، اترها ، آلدئیدها ، کتونها ،
اسیدها ، استرها و دهها ترکیب دیگر.
از آلکیل هالیدها ، میتوانید
واکنشگرهای گرینیار را بسازید و از واکنش این واکنشگرها با آلدئیدها و کتونها الکلهای پیچیدهتری را بدست آورید و غیره. در آن جزیره دور افتاده ، از الکلهای خود ، نه فقط بعنوان ماده خام استفاده میکنید، بلکه آنها را به دفعات ، بعنوان حلال برای انجام واکنشها و برای متبلور کردن فراوردهها بکار میبرید.
اهمیت الکلها
ما نمیتوانیم در هیچ یک از بخشهای شیمی آلی خیلی جلو برویم، بدون اینکه به الکلها بربخوریم. الکلها در استخلاف هسته دوستی بعنوان
سوبسترا و بعنوان هستهدوست شرکت میکنند. مهمترین و سادهترین اثر کاتالیزوری متعلق به الکلهاست که در شیمی انواع ترکیبها ، در لوله آزمایش و در ارگانیسم زنده ، نقش کلیدی برعهده دارد.
الکلها به آلکیل هالیدها و سایر ترکیباتی که استخلاف هستهدوستی انجام میدهند، تبدیل میشوند، استخلافی که معرفی انواع گروههای عاملی در یک مولکول را امکان پذیر میسازد. الکلها امکان دسترسی ما به ترکیبهایی با حالتهای اکسایش بالاتر ، یعنی آلدئیدها ، کتونها و اسیدهای کربوکسیلیک را فراهم میسازند.
ساختار الکلها
فرمول عمومی الکلها ، ROH است که در آن ، R یک گروه آلکیل یا آلکیل استخلاف شده است. این گروه میتواند نوع اول ، دوم یا سوم باشد، ممکن است زنجیرباز یا حلقهای باشد، ممکن است دارای یک
اتم هالوژن ، هیدروکسیلهای بیشتر یا یکی از بسیاری گروههای دیگری باشد که فعلا برای ما ناآشنا است.
همه الکلها ، دارای گروه هیدروکسیل (
-OH) هستند که بعنوان گروه عاملی ، خواص مشخصه این خانواده از ترکیبها را تعیین میکند. تغییر و تنوع در ساختار R میتواند بر سرعت واکنشهای الکلها و حتی در موارد معدودی بر نوع واکنشها نیز تاثیر گذارد.
 |
| فنل |
نکتهای در مورد تفاوت الکلها و فنلها
ترکیباتی که در آنها گروه هیدروکسیل مستقیما به یک حلقه آروماتیک متصل است، الکل نیستند، بلکه این ترکیبات ، فنل هستند و با الکلها آنچنان تفاوت فاحشی دارند که آنها را در مبحثی دیگر باید مورد بررسی قرار داد.
طبقهبندی الکلها
الکلها بسته به نوع کربن حامل گروه OH
- ، به سه دسته نوع اول ، نوع دوم یا نوع سوم طبقهبندی میشوند:
C(R)_3-OH ، C(R)_2H-OH ، CR(H)_2-OH .
یک واکنش اکسایش که مستقیما با دخالت اتمهای هیدروژن متصل به کربن حامل گروه OH
- انجام میشود، در طبقه از الکلها ، روندی کاملا متفاوت دارد.
اما ، معمولا ، الکلهای طبقات مختلف ، فقط از نظر سرعت یا مکانیسم واکنش و به هر طریقی هماهنگ با ساختارشان ، با هم تفاوت دارند. بعضی از استخلافها میتوانند آنچنان بر واکنش پذیری یک الکل تاثیر گذارند که آن را با الکلهای طبقههای دیگر مشابه سازند.
منابع صنعتی الکلها
الکلها ، موادی این چنین مهم در شیمی آلیفاتیک ، نه تنها باید از نظر واکنشها بسیار گوناگون و تنوع پذیر باشند، بلکه به مقدار زیاد و با قیمت ارزان نیز باید قابل تهیه باشند. برای بدست آوردن الکلهای سبک که تکیهگاه سنتز آلی آلیفاتیک هستند، سه روش اصلی وجود دارد، روشهایی که میتوانند همه منابع مواد آلی را مورد استفاده قرار دهند. یعنی
نفت ، گاز طبیعی ، زغال سنگ و
زیست توده. این سه روش عبارتند از:
- آبدارکردن آلکنهای بدست آمده از کراکینگ نفت.
- فرایند السک از آلکنها ، مونوکسید کربن و هیدروژن.
- تخمیر کربوهیدراتها.
علاوه بر این سه روش اصلی ، روشهای دیگری نیز با کاربرد محدود وجود دارند. بعنوان مثال ، متانول از هیدروژندار کردن کاتالیزوری مونوکسید کربن بدست میآید. مخلوط هیدروژن و مونوکسید کربن با نسبت ضروری ، از واکنش آب با
متان ، آلکانهای دیگر ، یا زغال سنگ در دمای بالا بدست میآید.

خواص فیزیکی الکلها
دمای جوش
در میان هیدروکربنها ، به نظر میرسد که عوامل تعیین کننده دمای جوش ، عمدتا
وزن مولکولی و شکل مولکول باشند. در الکلها ، با افزایش تعداد کربن ، دمای جوش بالا میرود و با شاخهدار کردن زنجیر ، دمای جوش پایین میآید، اما نکته غیر عادی در مورد الکلها این است که آنها در دمای بالا به جوش میآیند. این دمای جوش بسیار بالاتر از دمای جوش هیدروکربنها با وزن مولکولی یکسان است و حتی از دمای جوش بسیاری ترکیبها با قطعیت قابل ملاحظه بالاتر است.
دمای جوش بالای آنها ، به علت نیاز به انرژی بیشتر برای شکستن پیوندهای هیدروژنی است که مولکولها را در کنار هم نگه داشتهاند.
حل شدن الکلها
رفتار الکلها بعنوان حل شده نیز توانایی آنها برای تشکیل پیوندهای هیدروژنی را منعکس میکند. برخلاف هیدروکربنها ، الکلهای سبک با آب امتزاجپذیرند. از آنجا که
نیروهای بین مولکولی الکلها همانند نیروهای بین مولکولی آب است، دو نوع مولکول با یکدیگر قابل اختلاط هستند. انرژی لازم برای شکستن یک پیوند هیدروژنی بین دو مولکول آب یا دو مولکول الکل ، با تشکیل یک پیوند هیدروژنی بین یک مولکول آب و یک مولکول الکل تامین میشود.
دوشنبه 29/10/1393 - 11:14
دانستنی های علمی
| اسیدهای چرب به صورت آزاد به مقدار ناچیزی در سلولها و بافتها دیده میشوند. این ترکیبات که غنی از اکسیژن و کربن و هیدروژن هستند قسمتی از واحد ساختمانی بیشتر لیپیدها مانند چربیهای خنثی ، فسفوگلیسریدها ، گلیکولیپیدها و استرهای کلسترول را تشکیل میدهند. |
دیدکلی
چربیها یا لیپیدها ترکیبات آلی غیر محلول در آب هستند که میتوان آنها را بوسیله حلالهای غیر قطبی نظیر
کلروفرم ، اتر و بنزن از سلولها استخراج کرد. لیپیدها استرهای یک یا چند اسید با الکلها میباشند. بعضی از لیپیدها در ساختمان دیواره و غشای سلولی شرکت داشته و برخی دیگر ماده ذخیرهای انرژیزا را در داخل سلول تشکیل میدهند. اسیدهای چرب به صورت آزاد به مقدار ناچیزی در بافتها دیده میشوند.
ساختمان اسیدهای چرب
تاکنون بیش از هفتاد اسید چرب از نسوج گوناگون جدا کردهاند که همگی دارای زنجیره هیدروکربنی طولانی با یک عامل کربوکسیل انتهایی هستند. بعضی از آنها اشباع شده و برخی دارای یک ، دو یا سه پیوند دوگانه هستند و گروهی در زنجیر خود دارای شاخههای جانبی نیز میباشند. تعداد کربنها در اسیدهای چرب به استثنای چند مورد ، همیشه زوج است و احتمالا علت زوج بودن آسان تر بودن سنتز آنها در نزد جانداران است. فرمول کلی اسیدهای چرب
CH3-(CH2)n-COOH است که n از صفر تا 30 الی 40 تغییر میکند.
خواص اسیدهای چرب
اسیدهای چرب غیر اشباع دارای
نقطه ذوب پایینتری نسبت به اسیدهای چرب اشباع هستند و هر چه تعداد کربن اسید چرب بیشتر شود، نقطه ذوب بالاتر میرود. پیوند دوگانه در اسیدهای غیر اشباع بیشتر بین کربن 9 و 10 بوده و این پیوند دوگانه تقریبا در تمامی اسیدهای چرب غیر اشباع طبیعی در وضعیت ایزومر هندسی سیس (Cis) است. اسیدهای چرب با زنجیر طویل در آب غیر محلول هستند. ولی در قلیایی محلولاند و تشکیل
صابون سدیم یا
صابون پتاسیم میدهند. اسیدهای چرب غیر اشباع به سهولت اکسید میشوند. تند شدن چربیها بر اثر اکسید شدن و ایجاد عوامل اسیدی و آلدئیدی در چربیها است.
ساختمان و خواص انواع چربیها
چربیهای خنثی (آسیل گلیسرولها)
ترکیب اسید چرب و گلیسرول را
آسیل گلیسرول یا
گلیسرید مینامند. گلیسرول الکلی است که بیش از سایر الکلها در ساختمان لیپیدها دیده میشود و دارای 2 عامل الکلی نوع اول و یک عامل الکلی نوع دوم است. برحسب آن که یک ، دو یا سه اسید چرب با عوامل الکلی گلیسرول ترکیب شده باشد، به ترتیب مونو ، دی و تری آسیل گلیسرول بدست میآید. نقطه ذوب چربیها خنثی بستگی به نقطه ذوب اسید چرب ترکیبی آنها دارد. تری آسیلها در آب نسبتا نامحلول بوده و تشکیل میسلهای کامل نمیدهند. در حالی که دی آسیل گلیسرولها که تا حدودی قابل یونیزه شدن هستند، به سهولت تشکیل میسل میدهند.
فسفو گلیسریدها
این لیپیدها که به نام گلیسرول فسفاتید نیز موسومند، بیشتر در غشاهای سلولی وجود دارند و فقط به مقدار خیلی جزئی در چربیهای ذخیرهای یافت میشوند. الکل این لیپیدها گلیسرول است که یکی از عوامل الکلی نوع اول آن توسط
اسید فسفریک استریفیه شده است. تمام فسفر گلیسریدها دارای یک انتهای قطبی و دو انتهای طویل غیر قطبی میباشند و به این جهت آنها را
لیپیدهای قطبی یا آمفی پاتیک گویند.
پلاسمالوژنها
یک گروه فرعی از فسفر گلیسریدها هستند که در آنها به جای یک مولکول اسید چرب یک آلدئید چرب قرار گرفته است. این ترکیبات در غشای
سلولهای عضلانی و
عصبی فراوانند.
اسفنگو لیپیدها
اینها در غشای سلولهای گیاهی و سلولهای حیوانی و در بافتهای عصبی و مغز به مقدار فراوان وجود دارند. این ترکیبات در اثر هیدرولیز ایجاد یک مولکول اسید چرب و یک مولکول الکل آمینه غیر اشباع به نام
اسفنگوزین میکنند. در اسفنگو لیپیدها گلیسرول وجود ندارد. ترکیب اسفنگوزین و اسید چرب را
سرامید گویند. اسفنگو میلین ترکیب سرامید با فسفو کلین میباشد که فراوانترین اسفنگو لیپیدها است.
گلیکو لیپیدها
این ترکیبات دارای یک انتهای قطبی هیدروفیل (آبدوست) قندی میباشند. برخی شامل اسفنگوزین و برخی دیگر شامل گلیسرول هستند. قندهای آن شامل D- گلوکز و
D- گالاکتوز است. گانگلیوزیدها ترکیبات دیگری از دسته گلیکو لیپیدها هستند. این ترکیبات عبارتند از گلیکو اسفنگو لیپیدهایی که دارای انتهای قطبی متشکل از قندهای مرکب نظیر
اوزامین و
اسید سیالیک میباشند. این ترکیبات در غشای سلولی بویژه در سلولهای عصبی زیاد دیده میشوند.
سربروزیدها
این ترکیبات را میتوان در گروه گلیکو لیپیدها و یا اسفنگو لیپیدها طبقه بندی کرد. زیرا دارای
قند و اسفنگوزین هستند. این دسته از لیپید بیشتر در غشای سلولهای عصبی بویژه در غلاف میلین و همچنین در گویچههای قرمز خون ،
گویچههای سفید خون و
اسپرم دیده میشوند.
مومها
مومها از نظر ساختمانی و خواص ، شبیه آسیل گلیسرولها هستند. ولی الکلهای آنها دارای زنجیره کربنی طویل هستند که تنها شامل یک عامل الکل میباشند. این ترکیبات در
غشای محافظ پوست ، پر و جدار برگها و بعضی میوهها و پوسته خارجی بیشتر حشرات دیده میشوند.
لیپیدهایی که صابونی نمیشوند
لیپیدهایی که تاکنون مورد بحث قرار گرفتند قابل صابونی شدن بوده یعنی با قلیاییها و در اثر حرارت ایجاد صابون میکنند. در سلولها مقدار کمتری از نوع دیگر چربیها موجودند که غیر قابل صابون شدن هستند. دو گروه اصلی از این لیپیدها یکی استروئیدها و دیگری ترپنها هستند.
- استروئیدها: ساختار استروئیدها از سه حلقه شش ضلعی فنانترن و یک حلقه پنج ضلعی هستند. از میان مهمترین استروئیدهایی که در طبیعت دیده میشوند، اسیدهای صفراوی ، هورمونهای جنسی ، هورومونهای قسمت قشری غدد فوق کلیوی و ویتامین D و کلسترول را میتوان نام برد. استروئیدها به مقدار بسیار کم در سلولها موجودند و فقط یک نوع آنها که بطور کلی استرول نامیده میشود، بسیار فراوان است. کلسترول فراوانترین نوع استرولها در بافتهای حیوانی است. کلسترول در گیاهان دیده نمیشود. استرول موجود در گیاهان به نام فیتوسترولها مشهورند. قارچها و مخمرها حاوی استرولهایی به نام میکو استرول هستند. در این دسته ارگوسترول را میتوان نام برد که به ویتامین D تبدیل میشود.
- ترپنها: به مقدار جزیی در سلولها وجود دارند. ترپن ممکن است دارای ساختمان خطی یا حلقوی باشد. ویتامین A ، کاروتنها ، بیشتر اسانسها و ویتامین E و ویتامین K از ترپنها مشتق میشوند.
لیپو پروتئینها
لیپیدهای قطبی با پروتئینهای خاصی ترکیب شده و لیپید پروتئینها را میسازند. مانند لیپو پروتئینهای پلاسمای خون که نقش حامل مواد مختلف را دارا میباشند. برخی لیپیو پروتئینها دارای لیپیدهای خنثی مانند گلیسرول و آسترهای آن هستند. این ترکیبات وسیله انتقال چربیها از روده کوچک به کبد به بافت چربی و دیگر بافتها هستند. طبقه بندی لیپو پروتئینها بر مبنای وزن مخصوص آنها انجام میگیرد.
پروستا گلاندینها
این ترکیبات که برای نخستین بار در مایع منی و
غده پروستات یافت شدند، از یک اسید چرب غیر اشباعی 20 کربنه به نام
اسید آراشیدونیک مشتق شدهاند. این ترکیبات انواع مختلفی دارند که تاکنون متجاوز از 14 نوع پروستاگلاندین در مایع منی انسان و تعداد دیگری در سایر بافتها یافت شده است. پروستاگلاندینهای گروه E ، گروه F و گروه A و B نمونه این ترکیبات هستند. پروستاگلاندینها دارای اثرات فیزیولوژیک مختلفی مانند کاهش
فشار خون ، تنظیم عبور یونهای مختلف از غشای سیناپسهای عصبی و خنثی سازی اثر برخی هورمونها میباشند.
میسلها
لیپیدهای قطبی مانند اسیدهای چرب ساده و صابونها در محلولهای آبگون پخش شده و میسلها را بوجود میآورند که در آنها انتهای هیدروکربنی چون آبگریزند (هیدروفوب) از محلول آبگون رانده شده و ایجاد یک فاز آبگریز داخلی میکند و در نتیجه انتهای آب دوست (هیدروفیل) آنها به طرف خارج گرایش مییابد. تری آسیل گلیسرولها و کلسترول خود به خود تشکیل میسل نداده ولی در ساختمان مسیلی وارد شده و میسلهای مخلوط را میسازند. میسلها ممکن است تک لایه یا دو لایه باشند.
دوشنبه 29/10/1393 - 11:14
دانستنی های علمی
| مفهوم اسیدها و بازهای سخت و نرم (HSAB) که توسط رالف پیرسون گسترش یافت، به عنوان توضیحی برای دادههای مربوط به واکنشهای یونهای فلزی و آنیونها میباشد. این مفهوم از آن زمان تا به حال ، گستردهتر شده است، طوری که واکنشهای متعدد دیگری را دربر میگیرد و در این اواخر بر پایه ریاضی بیشتر استوار گردیده است. |
قواعد فاجانز در پیش بینی رفتار نمکهای خاص
در طی سالهای زیادی ، شیمیدانها سعی کردند مشاهدات تجربی همچون عدم انحلال پذیری هالیدهای نقره و نمکهای دیگر را که میتوان از آنها برای تفکیک یونهای فلزها به صورت گروهی ، برای شناسایی در طرح
تجزیه کیفی ، استفاده کرد، توضیح دهند.
فاجانز پیشنهاد کرد که عدم انحلال پذیری یک نمک در آب ، نتیجه تشکیل مقداری پیوند کووالانسی در این ترکیبات است، زیرا آب
ترکیباتی یونی را خیلی راحتتر از
ترکیبات کووالانسی حل میکند. او روابط زیر را پیشنهاد کرد:
- خصلت کووالانسی با افزایش اندازه آنیون و کاهش اندازه کاتیون افزایش مییابد.
- با افزایش بار روی هر از یک یونها ، خصلت کووالانسی افزایش مییابد.
- خصلت کووالانسی در کاتیونهای دارای آرایش الکترونی غیر گاز نجیب بیشتر است.
برای مثال ، 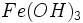 نسبت به
نسبت به  خیلی کمتر انحلال پذیر است. AgS نسبت به AgO خیلی کمتر انحلال پذیر است. نمکهای فلزهای واسطه بطور کلی نسبت به نمکهای فلزهای قلیایی و قلیایی خاکی کمتر انحلال پذیر هستند.
خیلی کمتر انحلال پذیر است. AgS نسبت به AgO خیلی کمتر انحلال پذیر است. نمکهای فلزهای واسطه بطور کلی نسبت به نمکهای فلزهای قلیایی و قلیایی خاکی کمتر انحلال پذیر هستند.
این قواعد در پیش بینی رفتار ترکیبهای خاص کاتیون _ آنیون نسبت به قواعد دیگر مفیدتر هستند، گرچه برای توجیه همه چنین واکنشهایی کافی نیستند. مفهوم HSAB دیدگاه کلیتری ارائه میکند که بعضی از استثناها را نیز دربر میگیرد.
اسیدهای نرم و اسیدهای سخت
آرلند ،
چات و
دیویس برخی از پدیدههای توضیح داده شده در فوق را از طریق تقسیم کردن یونهای فلزی به یونهای طبقه الف ، شامل اکثر
فلزات و یونهای طبقه ب ، گروهی کوچکتر که شامل یونهای
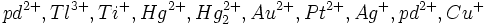
و
یونهای فلزات واسطه سنگینتر میباشد، طبقه بندی کردند. اعضای طبقه ب در منطقه کوچکی در جدول تناوبی ، گوشه پایین سمت راست فلزات واسطه ، قرار گرفتهاند.
یونهای طبقه ب ، هالیدهایی تشکیل میدهند که انحلال پذیری آنها به ترتیب F>Cl>Br>I است که عکس ترتیب انحلال پذیری هالیدهای دسته الف میباشد. یونهای فلزات طبقه ب همچنین آنتالپی واکنش بزرگتری با دهندههای فسفر نسبت به دهندههای نیتروژن دارند که باز هم عکس واکنشهای یونهای طبقه الف میباشد.
آرلند ، چات و دیویس ، فلزات طبقه ب را دارای الکترونهای dی قابل دسترس برای تشکیل
پیوند π توصیف کردهاند. از این رو ، حالتهای اکسایش بالای عناصر سمت راست فلزهای واسطه نسبت به حالتهای اکسایش پایین ، خصلت طبقه ب را بیشتر دارا هستند. برای مثال تالیم III و تالیم I ، در واکنش با هالیدها ، هر دو جزو طبقه ب محسوب میشوند، اما تالیم III خصلت طبقه ب را شدیدتر نشان میدهد، زیرا دو الکترون 6s در تالیم I ، الکترون 5d را پوشانده و مانع از قابل دسترس بودن آنها بطور کامل برای تشکیل پیوند π میگردند. عناصر سمت چپ جدول در حالتهای اکسایش پایین یا صفر که الکترونهای d بیشتری فراهم است، خصلت طبقه ب را بیشتر دارا هستند.
مولکولها یا یونهای دهندهای که آنتالپیهای واکنش با فلزات طبقه بی مطلوبتری دارند، آنهایی هستند که خیلی راحتتر قطبیده شده و دارای اوربیتالهای d یا *π خالی قابل دسترس برای تشکیل پیوند π میباشند.
پیوسون یونهای طبقه الف را به عنوان
اسیدهای سخت و یونهای طبقه ب را به عنوان
اسیدهای نرم در نظر گرفت.
بازهای نرم و بازهای سخت
بازها نیز با عناوین سخت و نرم طبقه بندی میشوند. برای مثال یونهای هالید از باز بسیار سخت
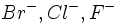
با سختی کمتر تا باز نرم

گستردهاند. مشاهده روند میزان سختی در بازها آسانتر است و برای هالیدها به ترتیب
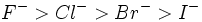
میباشد. باز هم تعداد بیشتر الکترون و بزرگتر بودن اندازه به رفتار نرمتر منجر میشود.
به عنوان مثال ،

از
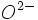
نرمتر است، زیرا در آن الکترونهای بیشتری در یک حجم اندکی بزرگتر پخش گردیده، باعث
قطبش پذیر شدن 
شدهاند. چنین مقایسههایی در داخل یک گروه آسان است. با تغییر ساختار الکترونی و اندازه ، مقایسه مشکلتر میشود، ولی هنوز امکانپذیر است. بدین ترتیب

از
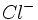
که همان ساختار الکترونی را دارد، نرمتر است. برای اینکه

بار هستهای کوچکتر و اندازه کمّی بزرگتر دارد. در نتیجه ، بار منفی برای قطبش قابل دسترستر است. مقادیر عددی با پارامترهای سختی و دادههای مربوطه اختصاص داده شده است.
تفاوت بین سخت و نرم
واکنشهای ناشی از برهمکنشهای
سخت _ سخت و
نرم _ نرم نسبت به واکنشهای مخلوط واکنشگرهای
سخت _ نرم مطلوبترند. تفاوت بین سخت و نرم به قطبش پذیری ، میزان سهولت انحراف مولکول یا یون در اثر برهمکنش با مولکولهای دیگر بستگی دارد. در مولکولهای قطبش پذیر ، الکترونها میتوانند توسط بارهای مولکولهای دیگر جذب یا دفع شده و گونههای بطور جزئی
قطبی که میتوانند با مولکولهای دیگر ترکیب شوند را تشکیل دهند.
اسیدها و بازهای سخت نسبتا کوچک ، متراکم و قطبش ناپذیر هستند. در حالی که اسیدها و بازهای نرم ، بزرگتر و قطبش پذیرتر (بنابراین نرمتر) هستند. از این رو ، هر کاتیونی با بار مثبت بزرگ (+3 یا بزرگتر) یا هر کاتیونی که الکترونها یا اوربیتالهای آن برای تشکیل پیوند π نسبتا غیر قابل دسترس هستند، جزو
اسیدهای سخت میباشد.
اسیدهای نرم آنهایی هستند که الکترونها یا اوبیتالهای d آنها برای تشکیل پیوند π به راحتی قابل دسترس است. علاوه بر این هرچه اتم سنگینتر باشد، برای نرم بودن مستعدتر است، زیرا تعداد زیاد الکترونهای داخلی ، الکترونهای بیرونی را حفاظت کرده و اتم را قطبش پذیرتر میسازد. این توصیف با یونهای طبقه ب بهتر مطابقت دارد. آنها عمدتا یونهای +1 یا +2 با اوربیتالهای d پر یا تقریبا پر هستند و اکثرا در ردیفهای دوم و سوم عناصر واسطه با تعداد 45 یا بیشتر الکترون قرار دارند.
مقایسه واکنشگری بر اساس سختی و نرمی
مقایسههای دقیقتر امکان پذیر است، ولی عامل دیگری به نام
قدرت اسید و باز ذاتی را نیز باید در این مقایسهها در نظر داشت. یک اسید یا باز ممکن است، سخت یا نرم و از طرف دیگر قوی یا ضعیف باشد. قدرت اسید یا باز ممکن است از ویژگیهای سختی _ نرمی آن مهمتر باشد. هر دو عامل را باید بطور همزمان در نظر گرفت. برای مثال ، اگر دو باز نرم برای یک اسید در رقابت باشند، بازی که قدرت بازی ذاتی آن بیشتر است، ممکن است ترجیح داده شود، مگر اینکه میزان نرمی آنها بطور چشمگیری تفاوت داشته باشد.
چنین مقایسههایی مستلزم دقت است. به ندرت یک عامل بطور کامل پاسخگوی واکنش میباشد و واکنش تقریبا همیشه رقابتی بین جفتهای اسید _ باز است. به عنوان مثال ، واکنش زیر را در نظر بگیرید. دو ترکیب سخت _ نرم واکنش داده و یک ترکیب سخت _ سخت و یک ترکیب نرم _ نرم ایجاد میکنند. با اینکه ZnO از قویترین اسید (

) و قویترین باز (
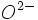
) ترکیب یافته است.
در معادله فوق واکنش دهندهها هر دو سخت _ نرم هستند، در حال که
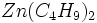
نرم _ نرم و
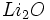
سخت _ سخت میباشند.
به عنوان یک قاعده کلی ، ترکیبهای سخت _ سخت از جنبه انرژی نسبت به ترکیبهای نرم _ نرم مطلوبترند. این توضیح هر موقع که در تشخیص عامل تعیین کننده در یک واکنش تردید پیش آید، ممکن است سودمند باشد.
دوشنبه 29/10/1393 - 11:13
دانستنی های علمی
نگاه اجمالی
بشر از دیر باز با مفهوم ساده اسید آشنایی داشته است. در حقیقت این مواد، حتی قبل از آنکه شیمی به صورت یک علم در آید، شناخته شده بودند. اسیدهای آلی همچون سرکه و
آبلیمو و
آب غوره از قدیم معروف بودند. اسیدهای معمولی مانند اسید سولفوریک ،
اسید کلریدریک و
اسید نیتریک بوسیله کیمیاگران قدیم ساخته شدند و بصورت محلول در آب بکار رفتند. برای مثال اسید سولفوریک را
جابربن حیان برای نخستین بار از تقطیر بلورهای
زاج سبز (
FeSO4.7H2O) و حل کردن بخارات حاصل در آب ، بدست آورد.
در طی سالیان متمادی بر اساس تجربیات عملی
لاووازیه (A.L.Lavoisier) چنین تلقی میگردید که اجزاء ساختمان عمومی کلیه اسیدها از عنصر اکسیژن تشکیل گردیده است. اما بتدریج این موضوع از نظر علمی روشن و اعلام گردید که چنانچه این موضوع صحت داشته باشد، بر خلاف عقیده اعلام شده در مورد اکسیژن ، این عنصر هیدروژن است. در حقیقت ، تعریف یک اسید بنا به فرمول اعلام شده از سوی
لیبیگ (J. Von Liebig) در سال
1840 عبارت است از:
| موادی حاوی هیدروژن که میتوانند با فلزات واکنش نموده و گاز هیدروژن تولید نمایند. |
نظریه فوق مدت پنجاه سال مورد استناد بوده است. بعدها با پیشرفت علم شیمی ، مفاهیم جدیدی درباره اسیدها اعلام شده که در زیر به بررسی آنها خواهیم پرداخت.
خواص عمومی اسیدها
- محلول آبی آنها یونهای پروتون آزاد میکند.
- موادی هستند که از نظر مزه ترشند.
- کاغذ تورنسل را سرخ رنگ میکنند.
- با برخی فلزات مانند آهن و روی ترکیب شده گاز هیدروژن میدهند.
- با قلیاها (بازها) واکنش نموده و املاح را تشکیل میدهند.
- با کربنات کلسیم (مثلا به صورت سنگ مرمر) بشدت واکنش دارند، بطوریکه کف میکنند و گاز کربنیک آزاد مینمایند.
نظریه آرنیوس درباره اسیدها
زمانیکه مفاهیم
یونیزاسیون ترکیبات شیمیایی در محلولهای آبی روشن گردید، مفهوم اسید بطور قابل ملاحظهای تغییر پیدا کرد. مطابق تعریف آرنیوس ، اسید ماده ایست که در آب یونیزه میشود و یون
+H3O که گاهی بصورت
+H نیز نشان داده میشود، تولید میکند.
(HCl -----> H+ + Cl-(aq
آرنیوس قدرت اسیدی را نیز بر همین اساس تفسیر کرد و گفت که اسید قوی ، در محلولهای آبی تقریبا، بطور کامل یونیزه میشود. در صورتیکه که میزان تفکیک اسید ضعیف کمتر است. توجه کنید که مفهوم آرنیوس بر یونهای آب استوار است. بر اساس تعریف آرنیوس میتوان نقش اکسیدهای اسیدی را نیز تفسیر کرد.
اکسیدهای اسیدی
اکسیدهای بسیاری از غیرفلزات با آب واکنش داده و اسید تولید میکنند، در نتیجه این مواد را اکسیدهای اسیدی یا ایندرید اسید مینامند.
N2O5(s) + H2O → H+ + NO3-aq
مفهوم آرنیوس ، به علت تاکید آن بر آب و واکنشهای محلولهای آبی ، با محدودیت روبهروست.
نظریه برونشتد- لوری درباره اسیدها
در سال 1923، یوهان برونشتد و تامس لوری ، مستقل از یکدیگر مفهومی گستردهتر برای اسیدها و بازها بیان کردند. بر اساس تعریف ، برونشتد - لوری ، اسید ماده ای است که یک پروتون به باز میدهد. اسیدها ممکن است مولکول یا یون باشند. با حذف پروتون ، اسید به باز (باز مزودج اسید 1) تبدیل میشود و با گرفتن پروتون ، باز اولیه ، یعنی باز 2 به اسید2 (اسید مزدوج باز 2) تبدیل میشود.
اسید 2 + باز 1 <----- اسید 1 + باز 2
قدرت اسیدها ، بر میل آنها برای از دست دادن یا گرفتن پروتون استوار است. هر چه اسید قویتر باشد، باز مزدوج آن ضعیفتر است. در یک واکنش ، تعادل در جهت تشکیل اسید ضعیفتر است. اسید پرکلریک ، HClO4 ، قویترین اسید است، و باز مزدوج آن ، یعنی یون پرکلرات ، -ClO4 ، ضعیفترین باز میباشد و H2 ، ضعیفترین اسید و باز مزدوج آن یعنی یون هیدرید ، +H قویترین باز میباشد.
نظریه لوییس درباره اسیدها
گیلبرت لوییس مفهوم گستردهتری برای اسیدها در سال 1938 پیشنهاد داد که پدیده اسید - باز را از پروتون رها ساخت. طبق تعریف لوییس ، اسید مادهای است که بتواند با پذیرش یک زوج الکترون از باز ، یک پیوند کوولانسی تشکیل دهد. در نظریه لوییس به مفهوم زوج الکترون و تشکیل پیوند کووالانسی تاکید میشود. تعریف لوییس در مورد اسیدها بسیار گستردهتر از آن است که برونشتد عنوان نموده است. ترکیبات شیمیایی که میتوانند نقش اسید لوییس داشته باشند، عبارتند از:
- مولکولها یا اتمهایی که هشتتایی ناقص داشته باشند.
(BH3 + F- → BH4-(aq
- بسیاری از کاتیونهای ساده میتوانند نقش اسید لوییس داشته باشند.
Cu+2 + 4NH3 → Cu(NH3)4+2
- برخی از اتمهای فلزی در تشکیل ترکیباتی مانند کربونیلها که از واکنش فلز با مونوکسید کربن تولید میشود، نقش اسید دارند:
Ni + 4CO → Ni(CO)4
- ترکیباتی که اتم مرکزی آنها تونایی گسترش لایه ظرفیتی خود را داشته باشند ، در واکنشهایی که این گسترش عملی شود، نقش اسید دارند، مثلا در واکنش مقابل ، لایه ظرفیتی اتم مرکزی (Sn) از 8 به 2 الکترون گسترش یافتهاست.
SnCl4 + 2Cl- → SnCl6-2aq
- برخی ترکیبات به علت داشتن یک یا چند پیوند دو گانه در مولکول ، خاصیت اسیدی دارند. مثلا CO2
قدرت اسیدی و ساختار مولکولی
به منظور بررسی رابطه بین ساختار مولکولی و قدرت اسیدی ، اسیدها را به دو نوع تقسیم میکنیم: هیدریدهای کووالانسی و اکسی اسیدها.
هیدریدها
برخی از ترکیبات کووالانسی دوتایی هیدروژندار (مانند HCl , H2) اسیدی هستند. دو عامل بر قدرت اسیدی هیدریدیک عنصر موثر است: الکترونگاتیوی عنصر و اندازه اتمی عنصر. قدرت اسیدی هیدریدهای عناصر یک تناوب ، از چپ به راست و همسو با الکترونگاتیوی عناصر ، افزایش مییابد. یک عنصر الکترونگاتیو ، الکترونهای بیشتری از هیدروژن میگیرد و خروج آن به صورت یک پروتون را سرعت میبخشد.
قدرت اسیدی هیدریدهای عناصر یک گروه، با افزایش اندازه اتم مرکزی افزایش مییابد. در تناوب دوم: NH3>H2O>HF در گروه VI به اینصورت است:
H2Te > H2Se > H2S > H2O
اکسی اسیدها
در این ترکیبات ، هیدروژن اسیدی به یک اتم O متصل است و تغییر در اندازه این اتم بسیار ناچیز است. بنابراین عامل کلیدی در قدرت اسیدی این اکسیاسیدها، به الکترونگاتیوی اتم Z مربوط میشود: H-O-Z .
اگر Z یک اتم غیرفلز با الکترونگاتیوی بالا باشد، سهمی در کاهش چگالی الکترونی پیرامون اتم O (علی رغم الکترونگاتیوی شدید اکسیژن) را دارد. این پدیده باعث میشود که اتم اکسیژن، با کشیدن چگالی الکترونی پیوند H-O از اتم H ، تفکیک آن را سرعت ببخشد و ترکیب را اسیدی بکند. هیپوکلرواسید ، HOCl ، اسیدی از این نوع است.
هرچه الکترونگاتیوی Z بیشتر باشد، الکترونهای پیوند H-O به میزان بیشتری از اتم H دور میشوند و حذف پروتون آسانتر است: HOCl > HOBr > HOI . در اکسی اسیدهایی که اتمهای اکسیژن بیشتری به Z متصل باشند، قدرت اسیدی با افزایش n ، زیاد میشود.
مهمترین اسیدهای قوی
مولکولهای این اسیدها و در محلولهای آبی رقیق کاملا یونیزه است. اسیدهای قوی متعارف عبارتند از: اسید کلریدریک ، یدیدریک ، نیتریک ، سولفوریک ، پرکلریک است.
مهمترین اسیدهای ضعیف
یونیزاسیون این اسیدها در آب کامل نمیباشد و هرگز به 100% نمیرسد. مثال متعارف آنها ، اسید استیک ، اسید کربنیک ، اسیدفلوریدریک ، اسید نیترو و تا حدودی اسید فسفریک است.
برخی از کاربردهای اسیدها
اسید سولفوریک
یکی از اسیدهای معدنی قوی با فرمول H2SO4 ، مایعی روغنیشکل و بیرنگ است. یک متاع سودمند صنعتی است که از آن در حد وسیعی در پالایش نفت و در کارخانجات تولید کننده کودها ، رنگها ، رنگدانهها ، رنگینهها و مواد منفجره استفاده میشود.
اسید استیک
یک اسید آلی بصورت مایعی تند و بی رنگ با فرمول CH3COOH ، که اساس ترشی سرکه نیز میباشد. قسمت اعظم اسیداستیک تولیدی دنیا ، مصرف واکنش با الکلها به منظور تولید استرهایی میگردد که از آنها بعنوان بهترین حلالها در رنگ و جلا استفاده میشود. همچنین در کارخانجات داروسازی، عمل آوردن لاستیک طبیعی و تهیه چرم مصنوعی و به عنوان حلال برای بسیاری از ترکیبات آلی از اسید استیک استفاده میشود.
اسید نیتریک
یک اسید قوی معدنی با فرمول HNO3 میباشد که این اسید در کارخانجات تولید کودهای نیترات و فسفات آمونیوم ، مواد منفجره نیترو ، پلاستیکها ، رنگینهها و لاکها کاربر دارد.
اسید سولفونیک
این اسیدها با فرمول عمومی HSO3R که R میتواند متان یا بنزن و ... باشد، محلول در آب ، غیر فرار و جاذب الرطوبهاند و به عنوان عوامل امولسیون کننده ، مواد افزودنی و روغنهای روان کننده و به عنوان جلوگیری از خوردگی و زنگ زدگی استفاده میگردد.
اسید کلریدریک
یکی از اسیدهای معدنی قوی با فرمول HCl ، که مایعی بیرنگ یا اندکی زردرنگ ، بسیار خورنده و غیر آتشگیر است. این اسید در آب ، الکل ، بنزن حل میشود و در اسیدی کردن (فعال کردن) چاههای نفت ، پاک کردن رسوبات دیگهای بخار ، صنایع غذایی ، تمیز کردن فلزات و ... استفاده میشود. دوشنبه 29/10/1393 - 11:13
دانستنی های علمی
 |
| ساختمان آمونیاک |
اطلاعات کلی
آمونیاک ، مهمترین ترکیب هیدروژنه ازت بوده ، در طبیعت از تجزیه مواد آلی ازت دار حاصل میگردد. این ماده ، گازیست بیرنگ با مزه فوقالعاده تند و زننده که اشکآور و خفهکننده نیز میباشد. گاز آمونیاک از هوا سبکتر بوده ، بهسهولت به مایع تبدیل میشود. آمونیاک در آب بسیار محلول است و در منهای 77,7 درجه سانتیگراد منجمد و در منهای 33,5 درجه سانتیگراد به جوش میآید.
وزن مخصوص محلول اشباع آمونیاک 0,88 گرم بر سانتیمتر مکعب است.
موارد استفاده
در کارخانجات یخ سازی ، در ساخت کودهایی از قبیل نیترات ، سولفات و فسفات آمونیوم ، تهیه اسید نیتریک ، دارو و
مواد منفجره بکار میرود.
آمونیاک تجارتی
محلول آمونیاکی که معمولا در تجارت ، خرید و فروش میشود، 20 تا 22 درجه سوم (20.7 درصد و تکاتف نسبی آن d=0,92) و یا 28 تا 29 درجه (32.7 درصد آمونیاک) میباشد.
روشهای تهیه آمونیاک
آمونیاک را میتوان اصولا از سه منبع زیر تهیه کرد:
- تقطیر زغال سنگ که از آبهای آمونیاکی آن ، ابتدا آمونیاک و سپس سولفات آمونیاک تهیه میکنند.
- سنتز مستقیم
- تهیه سینامالدئید و سیانوزها
تقطیر زغال سنگ برای تهیه آمونیاک
منظور از تقطیر زغال سنگ استفاده از گازهای سوختنی و یا کک برای صنایع فلزسازی است که بحث مفصلی را تشکیل میدهد و مربوط به این برنامه نیست. لیکن در این جا آن قسمت از عملیات تقطیر که مربوطه به تهیه آمونیاک و سولفات آن است، از نظر تکمیل این مبحث بررسی میشود.
زغال سنگ ، دارای 1 تا 1,5 درصد نیتروژن آلی است و در موقعیکه آب را تقطیر کنیم، قسمتی از این نیتروژن ، بصورت آزاد و قسمت دیگری به حالت آمونیاک و ترکیبات آمونیاکی فرار و غیر فرار از دستگاههای تقطیر خارج میشود و در خنک کننده هایی که به همین منظور بعد از قرنهای تقطیر قرار دادهاند، مخلوط با قطرانهای زغال سنگی جمع آوری میگردد.

نمکهای آمونیاکی
نمکهای آمونیاکی که از تقطیر زغال سنگ بدست میآیند، بر دو نوعند: نمکهای فرار مانند کربنات آمونیوم CO
3(NH
4)
2 و سولفیدرات SHNH
4 و S(NH
4)
2 که بهآسانی بوسیله بخار آب برده میشوند، نمکهای ثابت و غیر فرار مانند کلرید آمونیوم NH
4Cl و هیپوسولفیت S
2O
3(NH
4)
2 و غیره که بوسیله باز غیر فراری مانند آهک تجزیه میگردند.
ضمنا باید متذکر شد، آمونیاکی که از تقطیر یک تن زغال سنگ حاصل میشود، طبعا با مقدار ازت موجود در زغال متغیر است و این مقدار بین 1,4 کیلوگرم تا 4,6 کیلوگرم نوسان دارد و بهندرت در بعضی از انواع زغال سنگها این مقدار به 7,2 کیلوگرم میرسد.
معمولا هرگاه عمل تقطیر زغال سنگ را در مجاورت 2,5 درصد آهک انجام دهند، بهره آمونیاک تا 20 درصد افزایش نشان میدهد و به هر صورت ، آمونیاک و کلیه ترکیبات آمونیاکی را که در بالا نام بردیم، میتوان در دستگاههای خنک کننده از قطرانهایی که همراه آنها میباشند، جدا کرد و اصطلاح صنعتی این قبیل محلولهای آمونیاکی را
آبهای آمونیاکی مینامند که آنها را ابتدا در ستونی تقطیری وارد میکنند. سپس تحت تاثیر شیر آهک قرار میدهند و در آنجا آمونیاک و املاح فرار آنها بوسیله بخار آب برده میشوند، در حالیکه املاح غیر فرار تحت تاثیر شیر آهک ، تجزیه و به آمونیاک تبدیل میگردند.
خطرات آتش سوزی و انفجار
آمونیاک ، گازیست قابل اشتعال و حدود اشتعالش 16 تا 25 درصد حجمی گاز آمونیاک در هوا میباشد. حضور مواد نفتی و دیگر مواد قابل اشتعال ، خطر حریق را افزایش میدهند. محلول غلیظ اکسید نقره از محلول آمونیاک حل شده و تولید
فولمینات نقره به فرمول
CNOAg مینماید که ماده ای شدیداً قابل انفجار است. همچنین گاز آمونیاک در اثر حرارت از 400 درجه به بالا تجزیه شده ، تولید هیدروژن مینماید.

خطرات بهداشتی
سبب تحریکات سیستم تنفسی ، پوست و چشم شده و با آسیب رساندن به ریهها در اثر مواجهه با حجم زیاد این گاز میتواند سبب مرگ شود. در صورت تماس با آمونیاک مایع ، سوختگی شدید در محل تماس ایجاد میگردد. آستانه مجاز مواجهه با آن ، ppm 50 است و جهت کمکهای اولیه ، قسمتهای آلوده سطح بدن را با آب و صابون شسته و چشمها را نیز با آب فراوانی شستشو داد و به پزشک مراجعه نمود.
طریقه اطفاء حریق
در صورتیکه سیلندر گاز آمونیاک مشتعل شد، نباید شعله آن را خاموش نمود، مگر اینکه قبلاً بتوان جریان گاز را قطع کرد. در حین عملیات اطفاء ، باید سیلندرهای حاوی گاز آمونیاک را با آب خنک نمود. از پودر شیمیایی خشک یا گاز کربنیک یا آب بهصورت اسپری جهت اطفاء میتوان استفاده نمود. به هنگام عملیات باید از لباس کاملاً ایمن و سیستم حفاظتی دستگاه تنفس استفاده کرد.
طریقه نگهداری و حمل ونقل
آمونیاک باید در سیلندرهای استیل نگهداری و توسط تانکرهای مخصوص آن حمل گردد. باید سعی نمود از رسیدن تنشهای فیزیکی و حرارت زیاد به ظروف محتوی آمونیاک جلوگیری شود. انبار و محل نگهداری آن باید مقاوم در برابر حریق بوده و دارای سیستم اعلام و اطفاء اتوماتیک باشد. آمونیاک باید جدا از موادی چون گازهای اکسید کننده ، کلر ، برم ، ید و اسیدها نگهداری شود.
دوشنبه 29/10/1393 - 11:11
دانستنی های علمی
دیدکلی
پروتئینها ، زنجیرههای خطی یا پلیمرهایی هستند که از ترکیب اسیدهای آمینه حاصل میشوند. اسید آمینهها ، حروف الفبایی پروتئینها را تشکیل میدهند و چون امکانات بالقوه نامحدودی در طرز توالی و طول زنجیره اسید آمینهها در تولید پروتئینها وجود دارد، از اینرو انواع بیشماری از پروتئینها نیز میتوانند وجود داشته باشند.
اختلاف هر
اسید با سایر اسیدهای آمینه ، در زنجیره جانبی هر یک از اسیدهای آمینه است. اسیدهای آمینه در آغاز تشکیل زمین ، به همراه سایر مواد آلی پیدا شدند. اسیدهای آمینهای که در حضور پرتوهای فرابنفش بوجود آمدند، گوناگونی بسیار داشتهاند. اما به دلایلی ناشناخته تنها بیست اسید آمینه ، آن هم از نوع L ، در یاخته زنده کاربرد پیدا کرد.
ساختار اسیدهای آمینه
هر اسید آمینه ، از یک کربن نامتقارن به نام کربن آلفا تشکیل یافته است که با چهار گروه مختلف کربوکسیل (COOH) اتم هیدروژن ، گروه آمینه بازی (
NH2-) و یک زنجیره غیر جانبی (
R-) پیوند برقرار میکند. ریشه R ممکن است یک زنجیره کربنی و یا یک حلقه کربنی باشد. عوامل دیگری مانند الکل ،
آمین ، کربوکسیل و نیز گوگرد میتوانند در ساختمان ریشه R شرکت کنند. زنجیره جانبی خود چندین اتم کربن دارد و آنها را به ترتیبی که از کربن آلفا ، فاصله میگیرند، با حروف بتا (β) ، گاما (γ) و دلتا (δ) نشان میدهند.
اگر در حالی که عامل COOH روی کربن آلفا قرار داد عامل NH
2 روی کربنهایی غیر آلفا قرار گیرد. نوع اسید آمینه به β ، γ یا δ تغییر خواهد کرد. اسیدهای آمینه آزاد به مقدار بسیار ناچیز در سلولها وجود دارند. بیشتر اسیدهای آمینه آلفا در سنتز پروتئین شرکت میکنند، در صورتی که اسیدهای آمینه بتا ، گاما و دلتا واسطههای شیمیایی هستند. بیشتر اسیدهای آمینه در PH هفت به صورت دو قطبی در میآیند یعنی گروه NH
2 پروتون میگیرد و گروه COOH هیدروژن خود را از دست میدهد و به صورت –COO- در میآید.
ایزومری در اسیدهای آمینه
مطابق قرار داد اگر ساختمان فضایی یک اسید آمینه را در نظر بگیریم، چنانچه عامل NH
2 که به کربن آلفا متصل است در طرف چپ باشد، میگوییم که این اسید آمینه از نوع L است و هرگاه عامل NH
2 در طرف راست کربن آلفا قرار گیرد، گوییم که این اسید آمینه از نوع ∆ است. برخلاف قندهای طبیعی که از نوع دلتا هستند، اسیدهای آمینه طبیعی همگی از نوع L میباشند. ایزومرها را انانتیومر میگویند.
انواع اسیدهای آمینه
منو اسیدهای آمینه
- گلیکوکول (Gly):گلیکوکول که گلیسین نیز نامیده میشود و تنها اسید آمینهای است که فاقد کربن ناقرینه است و در ساختمان پروتئینهایی مانند کلاژن ، الاستین و رشته ابریشم به مقدار فراوان وجود دارد.
- آلانین (Ala): در تمام پروتئینها فراوان است.
- والین (Val): اسید آمینه ضروری برای انسان است و به مقدار کم در بیشتر پروتئینها یافت میشود.
- لوسین (Leu): اسید آمینه ضروری برای انسان بوده و در بیشتر پروتئینها به مقدار زیاد وجود دارد.
- ایزولوسین (Ile): اسید آمینه ضروری برای انسان است که به مقدار کمتر از اسیدهای آمینه دیگر پروتئینها وجود دارد. ایزولوسین دو کربن ناقرینه دارد.
اسید آمینه الکلدار
- سرین (Ser): اسید آمینهای است که در رشتههای ابریشم بسیار فراوان بوده و در ساختمان چربیها و پروتئینهای مرکب نیز شرکت میکند.
- تره اونین (Thr): اسید آمینه الکلداری است که برای انسان ضروری بوده و مانند ایزولوسین یک کربن ناقرینه اضافی دارد.
اسیدهای آمینه گوگرددار
- سیستئین (Cys): این اسید آمینه نقش مهمی در ساختمان فضایی پروتئینها بر عهده دارد زیرا عامل تیول (SH-) دو مولکول سیستئین در یک زنجیره پلی پپتیدی و یا دو مولکول سیستئین در دو زنجیره پلی پپتیدی با از دست دادن هیدروژن پیوند کوالان میسازند و در نتیجه دو مولکول سیستئین تبدیل به اسید آمینه دیگری به نام سیستئین میگردند.
- متیونین (Met): متیونین از اسیدهای آمینه ضروری برای انسان است که مقدار آن در پروتئینها نسبتا کم است.
دی اسیدهای منو آمینه
اسیدهای آمینهای هستند که دارای یک آمین و دو عامل کربوکسیل هستند و به اسید آمینه اسیدی مشهورند.
- اسید آسپارتیک (Asp): در پروتئینها به مقدار زیاد یافت میشود. اسیدیته این اسید آمینه زیاد است.
- اسید گلوتامیک (Glu): مقدار آن در پروتئین زیاد است و نقش مهم آن انتقال عامل آمین در واکنشهای بیوشیمیایی است.
اسیدهای آمینه آمیدی
این ترکیبات روی ریشه R دارای یک عامل آمیدی هستند. این اسیدهای آمینه در سنتز پروتئینها شرکت نموده و نقش مهمی را در انتقال آمونیاک دارا هستند.
- گلوتامین (Gln)
- آسپاراژین (Asn)
اسیدهای آمینه دی آمین
این اسیدهای آمینه دارای یک عامل آمین اضافی هستند.
- لیزین (Lys): این اسید آمینه برای انسان ضروری بوده و در بیشتر پروتئینها مخصوصا در بعضی از پروتئینها مانند هیستونها به مقدار فراوان دیده میشود. لیزین در سنتز کلاژن نیز شرکت میکند. ولی پس از تشکیل کلاژن ، لیزین به دلتا هیدروکسی لیزین تبدیل میشود.
- آرژنین (Arg): این اسید آمینه در پروتئینهایی مانند هیستون و پروتامین بسیار فراوان است. آرژنین بسیار بازی است. گروه انتهای این اسید آمینه را که شامل سه ازت میباشد، گوانیدین مینامند.
اسیدهای آمینه حلقوی
بعضی از این اسیدهای آمینه به علت دارا بودن
حلقه بنزنی ،
عطری (آروماتیک) نامیده میشوند و برخی دیگر دارای یک حلقه هترو سیلیک هستند.
- فنیل آلانین (phe): از اسیدهای آمینه ضروری برای انسان بوده و در پروتئینها به مقدار فراوان یافت میشوند. در ساختمان این اسید آمینه یک حلقه بنزنی و یک زنجیر جانبی آلانین شرکت دارد.
- تیروزین (Thr): این اسید آمینه به مقدار فراوان در پروتئینها دیده میشود. حلالیت آن در آب کم است. تیروزین را پاراهیدروکسی فنیل آلانین هم مینامند. زیرا از اکسیداسیون فنیل آلانین حاصل میشود.
- تریپتوفان (Trp): اسید آمینه ضروری برای انسان است که به مقدار کم در پروتئینها وجود دارد.
- هیستیدین (His): این اسید آمینه در تمام پروتئینها به مقدار اندکی وجود دارد و فقط مقدار آن در هموگلوبین نسبتا زیاد است.
- پرولین (Pro): اسید آمینهای است که در پروتئینهایی مانند کلاژن و رشتههای ابریشم به مقدار فراوان دیده میشود. این اسید آمینه نقش مهمی در ساختمان فضایی پروتئینها به عهده دارد. در حقیقت پرولین که از حلقه ایمین مشتق میشود، یک اسید ایمینه است. در کلاژن تعدادی از پرولینها به هیدروکسی پرولین تبدیل میشود.
اسیدهای آمینه ضروری
از نظر تغذیه ، اسید آمینهها را به دو دسته ضروری و غیر ضروری تقسیم میکنند. اسیدهای آمینه ضروری ، اسیدهای آمینهای هستند که سلولها قادر به سنتز نیستند، در صورتی که اسیدهای آمینه غیر ضروری توسط سلولها از سایر مواد ساخته میشوند. نوع اسیدهای آمینه ضروری در نزد گونههای مختلف جانداران متفاوت است.
دوشنبه 29/10/1393 - 11:11
اطلاعات دارویی و پزشکی
مقدمه
واکنشهای مختلفی که در داخل سلول انجام میگیرد به تشکیل ترکیبات زاید در سلول منتهی میشود. خروج این ترکیبات از سلول باعث تغییر ترکیب و خواص محیط اطراف سلول میشود. به تدریج آن را برای ادامه زندگی نامساعد میباشد. در اثر تخریب اسیدهای آمینه که طی آن گروه یا گروههای آمین اسید آمینه طبیعی بدن موجودات طی اکسایش برداشته میشوند و در صورتی که جهت سنتز ترکیبات نیتروژندار جدید یا در سایر کنش و واکنشهای متابولیسمی یاخته به مصرف نرسند مجتمع شده و به شکل قابل ترشح درمیآیند.
اشکال دفع نیتروژن در موجودات زنده
در جانوران مختلف ، نیتروژن گروه آمینو به یکی از سه شکل اصلی زیر ترشح میشود. اکثر موجودات آبزی نیتروژن را به صورت آمونیاک (NH
3) آزاد میسازنند. آمونیاک ترکیبی بسیار سمی است ولی به علت محلول بودن در آب سمیت آن برای موجود زنده کاهش مییابد. پرندگان و برخی از خزندگان نیتروژن را به صورت
اسید اوریک ترشح میکنند. اسید اوریک سمی نیست ولی در آب نامحلول است و به همین دلیل به صورت جاودانه موجود دفع میشود.
سایر موجودات ، نیتروژن را به صورت اوره به خارج ترشح میکنند اوره نسبت به NH
3 سمیت کمتری دارد و در آب نیز حل میشود. خون مواد نیتروژندار مثل
اوره و
اسید اوریک را میگیرد و در حین گردش در بدن همواره از کلیهها میگذرد. در کلیهها مواد نیتروژندار زاید آب اضافی و مواد دفعی دیگر از خون گرفته شده و به خارج دفع میگردد. غلظت اوره در پلاسمای خون 0.03 و مقدار آن را در
ادرار 2 درصد است.
چرخه اوره
در جانورانی به نام اورئوتلیک ، آمونیاک حاصل از اسید آمینه (گروه آمین به علت داشتن "pk بالا در PH خون به صورت
یون آمونیوم است)، در کبد بوسیله یک مکانیسم چرخهای به اوره تبدیل میشود. این چرخه نخستین بار توسط که
بس و همکارانش کشف و به نام چرخه اوره نامگذاری شد. سه ترکیب اصلی این چرخه اسید امینهها هستند. این سه ترکیب عبارتند از:
آرژنین که جزء اسیدهای آمینه اصلی سازنده پروتئینها است.
اورنیتین و
سیترولین دو اسید آمینه کمیاباند و منحصرا دراین چرخه وارد میشوند. آمونیاک حاصل از اسید آمینه در مجاورت ATP با CO
2 ترکیب شده و ترکیبی به نام
کربومویل فسفات میدهد.
CO2 + NH4+ + 2ATP + H2O → 2ADP + Pi
مراحل چرخه اوره
مرحله اول
آغاز چرخه با اورنیتین است که در مجاورت کربومویل فسفات به سیترولین مبدل میشود. آنزیم اورنتین ترانس کربامیلاز واکنش را کاتالیز میکند. این مرحله در ماتریکس میتوکندری انجام میگیرد مراحل بعدی در سیتوسل صورت میگیرد.
Pi + سیترولین<-------اورنیتین ترانس کربامیلاز------کربومویل فسفات + اورنیتین
مرحله دوم
مرحلهای است که در طی آن سیترولین با مصرف انرژی با آسپارتات ترکیب شده و آرژینینو سوکسینات میدهد. آنزیم آرژینییو سوکسینات واکنش را کاتالیز میکند.
ADP+H+ آرژینینو سوکسینات<-----آرژینینو سوکسینات سنتتاز ---ATP + آسپارتات + سیترولین
مرحله سوم
مرحله تبدیل آرژینینو سوکسینات به آرژنین تحت اثر آنزیم لیاز است طیاین واکنش فومارات - که یکی از واسطههای چرخه کربس است نیز حاصل میشود.
فومارات + آرژنین<-------لیاز-------آرژنینو سوکسینات
مرحله چهارم
در این مرحله تحت اثر آنزیم آرژیناز ، اوره فرآورده آغازگر چرخه اوره یعنی اورنیتین ساخته میشود.
اوره + اورنیتین <----آرژیناز--------H2O + آرژنیتین
نقصهای ژنتیکی چرخه اوره میتوانند زندگی افراد را به خطر اندازند
افراد مبتلا به
نقصهای ژنتیکی در هر کدام از آنزیمهای شرکت کننده در تولید اوره ، نمیتوانند غذاهای غنی از پروتئین را تحمل کنند. اسیدهای آمینهای که بیش از توان مورد نیاز روزانه برای سنتز پروتئین خورده میشوند، در کبد دآمینه شده و تولید آمونیاکی میکنند که نمیتواند به اوره تبدیل و در گردش خون منتقل گردد. آمونیاک شدیدا سمی است. درمانهای متعدی برای مبتلایان به نقص در چرخه اوره صورت میپذیرد. تجویز دقیق اسیدهای آروماتیک
بنزوات یا
فنیل استات در رژیم غذایی میتواند به کاهش مقادیر آمونیاک خون کمک کند.
سندرم اورمی
دیالیز در مبتلایان به نارسایی حاد کلیه وقتی سطح نیتروژن ، اوره سرم (SUN) آنها به 100 - 70 میلیگرم در دسیلیتر میرسد. یا هنگامی که کلیرانس کراتینین آنها به کمتر از 20 - 15 میلیلیتر در دقیقه کاهش مییابد، شروع میشود. به مجموعه نشانهها و علایمی که به علت آثار سمی افزایش مواد نیتروژنی و دیگر مواد زاید در خون ایجاد میشود،
سندرم اورمی گویند. وضعیت عقلانی و روانی این بیماران تغییر میکند و عاقبت دچار گیجی شده و نهایتا به اغما میروند.
دوشنبه 29/10/1393 - 11:10
اطلاعات دارویی و پزشکی
نگاه کلی
بیشتر مردم با عمل کلیه آشنا هستند - پاک کردن بدن از مواد زاید که یا خورده میشوند یا توسط متابولیسم تولید میشوند - عمل دوم که بویژه جنبه حیاتی دارد کنترل حجم و ترکیب مایعات بدن است. زیرا تعادل آب و عملا تمام الکترولتها در بدن بین مقدار ورودی (توسط خوردن یا تولید متابولیک) و مقدار خروجی (توسط دفع یا مصرف متابولیک) تا حدود زیادی توسط کلیهها حفظ میشود.
این عمل تنظیمی کلیهها محیط پایدار سلولها را که برای آنها لازم است تا بتوانند فعالیتهای مختلف خود را انجام دهند حفظ میکند. کلیهها مهمترین اعمال خود را با فیلتره کردن پلاسما و حذف مواد از فیلترها به میزان متغیر بسته به نیازهای بدن انجام میدهند در نهایت امر ، کلیهها مواد ناخواسته را از فیلترا (خون) توسط دفع آنها در ادرار پاک میکنند. در حالی که مواد مورد نیاز را دوباره به خون باز میگردانند.
اعمال کلیه
- تنظیم تعادل آب و الکترولیتها
- تنظیم تعادل اسید و باز
- تنظیم اسمولالیته و غلظت الکترولیتهای ماعات بدن
- دفع فراورده های زاید متابولیک و مواد شیمیایی خارجی
- تنظیم فشار شریانی
- ترشح هورمونها
- نوسازی گلوکز
تنظیم تعادل آب و الکترولیتها
به منظور حفظ هوموستازی ، دفع آب و الکترولیتها باید دقیقا با مقدار ورودی آنها هماهنگ باشد. اگر مقدار ورودی از مقدار دفع شده تجاوز کند مقدار آن ماده در بدن افزایش خواهد یافت. اگر مقدار ورودی از مقدار دفع شده کمتر باشد، مقدار آن ماده در بدن کاهش خواهد یافت. مقادیر ورودی آب و بیشتر الکترولیتها معمولا بطور عمده تحت تاثیر عادات خوردنی و آشامیدنی شخص قرار دارد و این امر ایجاب میکند که کلیهها میزان دفع خود را تنظیم کنند. تا با مقادیر ورودی مواد مختلف هماهنگی داشته باشد اگر فردی میزان مصرف سدیم خود را یک دفعه 10 برابر کند و از مقدار کم 30 میلی
اکی والان در روز به مقدار زیاد 300 میلی اکی والان در روز نشان میدهد.
در ظرف 2 تا 3 ساعت بعد از زیاد کردن سدیم خوراکی ، دفع کلیوی نیز به حدود 300 میلی اکی والان افزایش مییابد. بطوری که تعادل بین مقدار ورودی و مقدار خروجی دوباره برقرار میشود. اما در جریان 2 تا 3 ساعت سازش کلیوی با این مقدار ورودی زیاد سدیم ، تجمع مختصر سدیم بوجود میآید که حجم مایع خارج سلولی را مختصر بالا میبرد و موجب بروز تغییرات هورمونی و سایر پاسخهای جبرانی میشود که به کلیهها علامت میدهند تا دفع سدیم خود را افزایش دهند. ظرفیت کلیهها برای تغییر میزان دفع سدیم در پاسخ به تغییرات مقدار ورودی سدیم فوق العاده عظیم است.
دفع فرآوردههای زاید متابولیک و مواد شیمیایی خارجی
کلیهها راه اصلی برای دفع فراوردههای زاید متابولیسم که دیگر مورد نیاز نیستند به شمار میرود. این فراوردهها شامل اوره (از متابولیسم اسیدهای آمینه)،
کراتینین (از کراتین عضله) ،
اسید اوریک (از اسیدهای نوکلئیک)، فراوردههای نهایی تجزیه هموگلوبین (از قبیل بیلی روبین) و متابولیتهای هورمونهای مختلف هستند.
همانند الکترولیتها ، این فرراوردهای زاید باید به همان سرعتی که تولید میشوند از بدن دفع گردند کلیهها همچنین سموم و سایر مواد شیمیایی خارجی را که یا توسط بدن تولید میشوند یا خورده میشوند از قبیل
سموم دفع آفات ، داروهای و مواد اضافه شده به غذاها را دفع میکنند.
تنظیم فشار شریانی
کلیهها با دفع مقادیر متغیر سدیم و آب نقش برتر را در تنظیم دراز مدت فشار شریانی بازی میکنند. علاوه بر آن کلیهها با ترشح عوامل یا مواد موثر بر عروق از قبیل رنین که منجر به تشکیل فراوردههای موثر بر عروق میشوند به تنظیم کوتاه مدت فشار شریانی کمک میکنند.
تنظیم تعادل اسید – بازی
کلیهها همرا با ریهها و بافرهای مایعات بدن با دفع اسیدها و تنطیم ذخایر با فرهای مایعات بدن با دفع
اسیدها و تنظیم ذخایر بافرهای
مایعات بدن به تنظیم اسیدی - بازی کمک میکنند. کلیهها تنها راه برای دفع بعضی انواع اسیدهای تولید شده توسط متابولیسم پروتئینها از قبیل اسید سولفوریک و
اسید فسفریک از بدن هستند.
ترشح هورمون
کلیهها اریتروپویتن ترشح میکنند که تولید گویچههای سرخ خون را تحریک میکند. یک محرک مهم برای ترشح اریتروپوتین توسط کلیهها هیپوکسی است. در شخص طبیعی ، کلیهها تقریبا مسئول تمام اریتروپوتین ترشح شده به داخل گردش خون هستند در افراد مبتلا به بیماری شدید کلیوی یا کسانی که کلیههایشان خارج شده و همودیالیز میشدند آنمی شدید در نتیجه کاهش تولید
اریتروپوتین بوجود میآید.
تنظیم اسمولالیته و غلظت الکترولیتهای مایعات بدن
کلیهها نوع فعال ویتامین D یعنی 1 و 25 دی هیدروکسی ویتامین D3 را توسط هیدروکسیلاسیون این ویتامین در وضعیت شماره «1» تولید میکنند. ویتامین D نقش مهمی در تنظیم کلسیم و فسفات بازی میکند.
نوسازی گلوکز
کلیهها گلوکز را از اسیدهای آمینه و سایر پیش آهنگها در جریان روزه داری طولانی توسط روشی مرسوم به نوسازی گلوکز یا گلوکونئوژنز سنتز میکنند. ظرفیت کلیهها برای اضافه کردن گلوکز به خون در جریان دورههای طولانی روزه دازی با ظرفیت کبد رقابت میکند. در بیماری مزمن کلیوی یا نارسایی حاد کلیهها ، این اعمال هموستاتیک مختل میشوند و اختلالات شدید حجم و ترکیب مایعات بدن به سرعت ایجاد میشوند. در نارسایی کامل کلیه تجمع کافی پتاسیم ، اسیدها ، مایع و سایر مواد در ظرف چند روز در بدن به وجود میآید که میتواند موجب مرگ شود مگر اینکه دخالتهای بالینی از قبیل همولیز انجام شوند تا لااقل تا حدودی تعادل مایع و الکترولیتهای بدن را مجددا برقرار سازد
دوشنبه 29/10/1393 - 11:10