
قانون سرعت و مرتبه واکنش
در مطالب قبلی از سرعت واکنش به تفصیل صحبت کردیم. در این بخش به معادله سرعت خواهیم پرداخت و نحوه تشخیص مرتبه واکنش را بیان می کنیم. همچنین پیرو بحث های قبلی مربوط به واکنش های کامل و تعادلی ، در اینجا با واکنش های مرتبه صفر نیز آشنا خواهیم شد.
قانون سرعت:
رابطه بین غلظت مواد واکنش دهنده و سرعت واکنش به صورت یک معادله ریاضی بیان می شود که به آن قانون یا معادله سرعت می گویند.
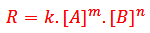
در این معادله k ، ثابت سرعت واکنش است که به دما، ماهیت واکنش دهنده ها و انرژی فعال سازی واکنش بستگی دارد و برای هر واکنشی به صورت تجربی مشخص می شود. توان غلظت ها (m و n ) می توانند به صورت اعداد صحیح یا اعشاری باشد. از روی معادله سرعت می توانیم سرعت لحظه ای واکنش را تعیین کنیم همچنین می توانیم بفهمیم با چند برابر شدن هر یک از غلظت ها سرعت واکنش چند برابر می شود.

نکته:
نکته:
تمرین: در واکنش فرضی :
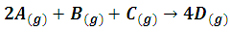
در یک آزمایش با دو برابر کردن غلظت A ، سرعت واکنش 4 برابر شده است. در آزمایش دوم با دو برابر کردن غلظت B ، سرعت واکنش هیچ تغییری نکرده است و بالاخره در آزمایش سوم با دو برابر کردن غلظت C ، سرعت واکنش دو برابر شده است، معادله سرعت واکنش را بنویسید .
آزمایش اول : R’= 4R
آزمایش دوم: R’=R
آزمایش سوم: R’ =2R
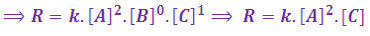

مجموع ضرایب استوکیومتری واکنش برابر 4 است در نتیجه واکنش قطعا چند مرحله ای است ( با توجه به درس ساز و کار واکنش شیمیایی) . در واکنش های چند مرحله ای نمی توان از روی ضرایب استوکیومتری هر ماده توان غلظتشان را بدست آورد اما می توان با تاثیراتی که افزایش غلظت روی سرعت دارد به معادله رسید. نبود ماده B در معادله سرعت واکنش نشان می دهد این ماده در آهسته ترین مرحله این واکنش شرکت نداشته است.
مرتبه واکنش:
به مجموع توان غلظت مواد در قانون سرعت واکنش مرتبه واکنش می گویند. در قانون سرعت m و n هریک به ترتیب مرتبه واکنش را نسبت به مواد A و B نشان می دهند.
واکنش های مرتبه صفر:
به واکنش هایی که در معادله سرعت آنها، توان غلظت همه مواد برابر صفر بوده و سرعت واکنش مستقل از غلظت واکنش دهنده ها باشد، واکنش مرتبه صفر می گویند. این امر باعث می شود، به مرور زمان که ماده واکنش دهنده مصرف می شود و غلظت آن کاهش می یابد، واکنش مرتبه صفر با سرعت ثابتی پیشرفت کند.

نکته:
در واکنش های مرتبه صفر، شیب منحنی " غلظت – زمان" ثابت است، چون سرعت ثابت است. اما شیب منحنی " سرعت – زمان" صفر است.
تذکر:
اگر واکنش در سوال مرتبه صفر باشد، طراح ذکر می کند.سوال:
با توجه به اطلاعات مقابل، کدام گزینه درست است؟
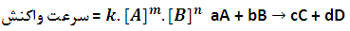
1) m و n برابر ضرایب استوکیومتری A و B هستند.
2) K کمیتی تجربی است و ثابت مرتبه واکنش نام دارد.
3) اگر مقدار m یا n برای واکنشی صفر به دست بیاید، سرعت واکنش با غلظت واکنش دهنده رابطه عکس خواهد داشت.
4) m و n می توانند عددهایی درست یا اعشاری باشند.

















