
نظریه ی برخورد
در این مطلب سعی خواهیم کرد تا منشأ انجام واکنش را در هنگام رسیدن مولکول ها به همدیگر را بررسی کنیم.
برای این که واکنشی اتفاق بیفتد، باید مولکول ها به همدیگر برخورد کنند. فراوانی برخورد یا تعداد برخوردها در واحد زمان توصیف می کند که یک مولکول خاص چند بار با مولکول های دیگر در واحد زمان برخورد انجام می دهد.
با وجودی که برای ایجاد یک واکنش، اجزای آن باید برخورد کنند اما تمام برخوردها منجر به واکنش نمی شوند. برای این که مولکول ها برخورد کنند، یک شیمی فیزیک دان به نام اس. آرنیوس توضیح داد که مولکول های در حال برخورد باید انرژی جنبشی کافی برای غلبه به نیروهای دافعه و نیروهای پیوندی واکنش دهنده ها داشته باشند. کم ترین انرژی لازم برای این که واکنش شیمیایی اتفاق بیفتد، انرژی فعالسازی نامیده می شود.
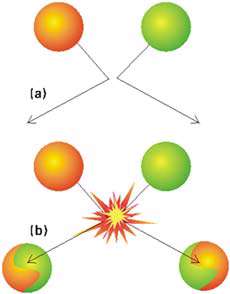
تأثیرات انرژی:
اگر اتم ها با انرژی کم تر از انرژی فعال سازی به هم برخورد کنند، از کنار هم پرش کرده و به عقب رفته و از هم دور می شوند. تنها برخوردی که در آن ذرات، انرژی مساوی یا بزرگ تر از انرژی فعال سازی داشته باشند، یک واکنش درست را ایجاد می کند. در نهایت، واکنش های شیمیایی با شکستن برخی پیوندها (که این عمل، انرژی می گیرد) و به وجود آمدن پیوندهای جدید ( که در این عمل، انرژی آزاد می شود). انرژی فعال سازی، کلیدی برای شکستن پیوندهای اولیه است. وقتی برخوردها بسیار آهسته هستند، مقدار کافی انرژی حاصل نخواهد شد و واکنش انجام نخواهد شد.
انرژی فعالسازی یک عامل تعیین کننده در آهنگ واکنش است زیرا با وابستگی به این که چه قدر انرژی جنبشی برای برخورد لازم است، سرعت و تعداد برخوردها در واحد زمان تغییر خواهد کرد.
توزیع ماکسول بولتزمن:
در ادامه ی مطالب مربوط به انرژی برخوردی بهتر است نسبت های متنوع اتم هایی که در هنگام برخورد، انرژی کافی منجر به واکنش را دارند، بدانیم. گازها می توانند بر روی نموداری که به نمودار توزیع ماکسول - بولتزمن معروف است، رسم شوند. این نمودار، اتم ها یا ذرات مختلف و انرژی های آن ها را نشان می دهد (شکل 1).
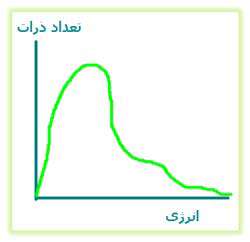
شکل 1: تعداد ذرات بر حسب انرژی
در این نمودار می بینیم که:
- بیش تر ذرات، مقدار متوسطی انرژی دارند.
- مقدرا کمی از ذرات دارای انرژی بسیار بالایی هستند.
- عده ی کمی از ذرات نیز انرژی های بسیار کمی دارند.
تقریباً آهنگ تمام واکنش های شیمیایی با افزایش دما، زیاد شود. ذراتی که با سرعت حرکت می کنند، غالباً بیش تر به هم برخورد کرده و انرژی جنبشی بزرگ تری دارند. برخوردهای مؤثر به طور نمایی با افزایش دما زیاد می شوند (شکل 2). در یک دمای مشخص، تنها کسری از مولکول ها انرژی کافی برای برخورد دارند (شکل 3).
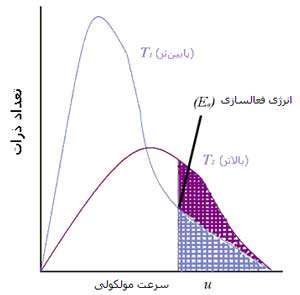
شکل 2
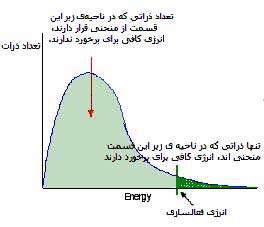
شکل 3
تأثیرات جهت:
در هر برخوردی با اتم های نامتقارن، جهت های اتم ها در طول برخورد در ایجاد واکنش، نقش تعیین کننده ای دارد. آهنگ واکنش از جهت برخورد ذرات تأثیر می-گیرد زیرا بدون جهت مناسب در هنگام برخورد، واکنش ابداً اتفاق نمی افتد.
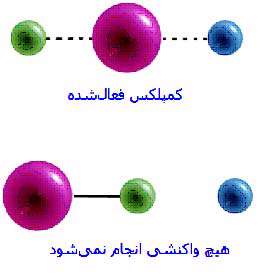
مثال 1:
برخورد کلرید هیدروژن با اتان (کربن با آبی تیره، هیدروژن با رنگ زرد و کلرید با آبی روشن نشان داده شده اند.) :
یک برخورد بین دو مولکول اتان (CH2=CH2) و کلرید هیدروژن (HCl) که منجر به تولید کلرواتان می شود. به دلیل برخورد، پیوند دوگانه در میان دو اتم کربن به پیوند یگانه تبدیل می شود. یک اتم هیدروژن به یکی از کربن ها متصل می شود و یک اتم کلر به دیگری وصل می شود. اگر سمت هیدروژنی HCl به پیوند دوگانه ی کربن- کربن نزدیک شود، واکنش می تواند اتفاق بیفتد. اگر این برخورد به روش دیگری صورت گیرد، واکنش انجام نمی شود.
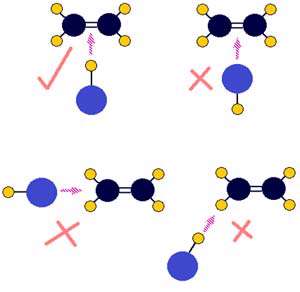
مثال 2:
زمانی که دو اتم هیدروژن با هم ترکیب می شوند تا یک مولکول هیدروژن ایجاد کنند، هیچ پیوندی از بین نمی رود (یک پیوند H-H ایجاد می شود) . اتم های هیدروژن به صورت کاملاً کروی هستند و از هر طرف متقارن اند؛ این به معنای آن است که جهت برخورد هیدروژن ها هرچه که باشد، واکنش بین اتم های هیدروژن صورت می گیرد، شکل زیر (برعکس مثال قبل که مولکول ها نامتقارن بودند و برخورد در هر جهتی صورت نمی گرفت).
خودآزمایی:
در یک بشر با گنجایش 10 ml، 10 ml مخلوط ریخته شده و در بشر دیگر با گنجایش 20 ml، 10 ml مخلوط ریخته شده است. در کدام بشر برخوردهای منجر به واکنش بیش تری صورت می گیرد؟
(الف) بشر اول – چون غلظت در فضایی که حجم کمی دارد، بیش تر است و اتم ها شانس بیش تری برای داشتن انرژی کافی و برخورد در جهت درست دارند.
(ب) بشر اول- چون در حجم کم، غلظت کمی وجود دارد و برخوردهای منجر به واکنش بیش تری صورت می گیرد.
(ج) بشر دوم – چون حجم بیش تری دارد و تعداد برخوردهای منجر به واکنش در آن بیش تر است.
(د) بشر دوم – چون حجم بیش تری دارد ولی مخلوط کم تر. بنابراین تعداد برخوردهای منجر به واکنش بیش تری در آن صورت می گیرد.
مرکز یادگیری سایت تبیان -تهیه: خدیجه آلچالانلو
تنظیم: نوربخش

















