عدد اکسایش
در مبحث الکتروشیمی با عدد اکسایش بسیار مواجه خواهید شد. لذا بهتر این است که ابتدا با مفهوم عدد اکسایش و نحوهی تعیین آن آشنا شوید. با ما همراه باشید.
تعریف عدد اکسایش:
به مجموع بارهای الکتریکی ظاهری نسبت داده شده به یک اتم با فرض یونی بودن پیوندها عدد اکسایش آن اتم گفته میشود. به عنوان مثال در مولکول HCL، اتم الکترونگاتیوتر یعنی کلر جفت الکترون پیوندی را به سمت خود کشیده و دارای جزیی بار منفی میشود و اتم هیدروژن که الکترونگاتیوی کمتری دارد جزیی بار مثبت پیدا میکند. پیوند بین کلر و هیدروژن از نوع کووالانسی قطبی است اما برای تعیین عدد اکسایش اتم ها بار 1+ را به هیدروژن و بار 1ـ را به کلر نسبت میدهیم و پیوند را یونی فرض میکنیم.در نتیجه با فر اینکه اتم کلر جفت الکترون پیوندی را کاملا از هیدروژن جدا میکند عدد اکسایش 1ـ خواهد داشت و هم چنین عدد اکسایش اتم هیدروژن 1+ میشود.
روشهای تعیین عدد اکسایش:
برای تعیین عدد اکسایش دو راه وجود داد:
١ـ استفاده از ساختار الکترون ـ نقطه ای
٢ ـ تشکیل معادله
روش اول بیشتر در مواردی استفاده میشود که تعداد اتم ها زیاد باشد و یا این که از یک عنصر چند اتم داشته باشیم برای مثال در ترکیبهای آلی که بیش از یک اتم کربن با عددهای اکسایش مختلف دارند استفاده از ساختار الکترون ـ نقطهای بهتر است. روش دوم در ترکیبهای معدنی و ذراتی که تعداد اتمهای آن ها نسبتاً کم است راحت تر میباشد.
تعیین عدد اکسایش با استفاده از ساختار الکترون ـ نقطهای:
بهتر است با ذکر یک مثال به شرح مراحل این روش بپردایم. میخواهیم عدد اکسایش اتمهای موجود در هیدروژن پراکسید (H2O2) را بدست آوریم.
١ـ ابتدا ساختار الکترون ـ نقطهای هیدروژن پراکسید را رسم میکنیم.
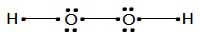
٢ـ همهی پیوندها را یونی فرض کرده وجفت الکترون پیوندی بین دو اتم مختلف را به اتم الکترونگاتیوتر نسبت میدهیم. یعنی در پیوند O-H جفت الکترون پیوندی به طور کامل به اکسیژن که الکترونگاتیوتر است داده میشود. اگر دو اتم یکسان باشند، پیوند به طور فرضی نصف میشود یعنی هر یک از الکترونهای پیوندی را به یکی از اتم ها نسبت میدهیم. برای مثال در پیوند O-O یک الکترون برای اکسیژن سمت راست و یک الکترون برای اکسیژن سمت چپ در نظر گرفته میشود.
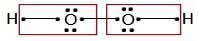
٣ـ همهی الکترونهای ناپیوندی روی هر اتم برای همان اتم باقی میماند.
٤ـ نهایتاً عدد اکسایش را از رابطهی زیر به دست میآوریم:
تعداد الکترون های لایه ی ظرفیت نسبت داده شده به آن اتم - عدد یکان شماره گروه =عدد اکسایش هر اتم
بدین ترتیب خواهیم داشت:
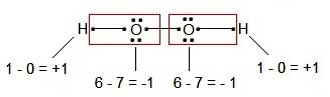
نکته : عدد یکان شمارهی گروه در واقع تعداد الکترونهای لایهی ظرفیت در حالت تک اتمی است.
از آن جایی که روش تشکیل معادله دارای نکات ریز بسیاری است، ترجیح بر این است که در مطلب جداگانه ای به آن پرداخته شود. لذا در مقالهی بعد میتوانید با نحوهی استفاده از این روش آشنا شوید.

















