
نظریه ها ی اسید و باز
برای فهم بهتر این مطلب، مطالعه ی مطالب
توصیه می شود.
بازهای لوئیس:
بهتر است این رابطه را با این نظر شروع کنیم که بازهای برونشتد- لوری زمانی که یون های هیدروژن می پذیرند، چه کاری انجام می دهند؟
در این جا سه باز برونستد - لوری آمونیاک، آب و یون هیدروکسید را بررسی کرده و وضعیت برای بقیه ی بازها نیز به همین ترتیب است.

نظریه ی اسید و باز برونشتد- لوری می گوید:
این مواد (آمونیاک، آب و یون هیدروکسید) نقش بازی دارند زیرا با یون هیدروژن ترکیب می شوند. دلیل ترکیب آن ها با یون هیدروژن آن است که همگی جفت الکترون تنها دارند و این همان چیزی است که نظریه ی اسید و باز لوئیس نیز به آن اشاره کرده است. تا این قسمت، این دو نظریه کاملاً با هم سازگاری دارند.
- پس به نظر شما نظریه ی لوئیس چگونه مفهوم یک باز را توسعه می دهد؟
در نگاه اول، چیزی به نظر نمی رسد و این دو نظریه فقط از دو زاویه ی متفاوت به مفاهیم اسید و باز پرداخته اند. اما در مورد دیگر واکنش های آب و آمونیاک نیز وضعیت به همین ترتیب است؟
در نظریه ی لوئیس، هر واکنشی که در آن آمونیاک یا آب، جفت الکترون های تنهای خود را برای تشکیل پیوند کوئوردینانسی استفاده کرده اند، آن ها را به عنوان باز معرفی خواهد نمود.

حال واکنشی را بررسی می کنیم . و بهتر است مطلب مربوط به پیوند کوئوردینانسی را نیز قبل از آن مطالعه کنید...
آمونیاک با BF3 واکنش می دهد و از جفت الکترون تنهای خود استفاده می کند تا یک پیوند کوئوردینانسی با اوربیتال خالی بور (B) تشکیل دهد.
تا آن جا که آمونیاک درگیر واکنش است، دقیقاً همانند وقتی رفتار می کند که با یون هیدروژن واکنش می دهد (یعنی در این مورد هم با استفاده از جفت الکترون تنهای خود، پیوند کوئوردینانسی با یون هیدروژن تشکیل می دهد). بنابراین اگر قصد دارید آمونیاک را در این بحث به عنوان باز در نظر بگیرید، در موارد دیگر هم به عنوان باز خواهد بود.
اسیدهای لوئیس:
اسید های لوئیس، پذیرنده های جفت الکترون هستند. در مثال قبل، BF3 با پذیرفتن جفت الکترون تنهای نیتروژن، نقش اسید لوئیس را دارد. در نظریه ی برونشتد- لوری، BF3 ابداً خاصیت اسیدی ندارد.
سؤال:
در مورد واکنش های اسید و باز دیگر (برای مثال، واکنش بین آمونیاک و گاز کلرید هیدروژن) وضعیت چگونه است؟
(NH3(g) + HCl (g) ........ NH4+(s) + Cl- (s
چه چیزی دقیقاً جفت الکترون تنهای روی نیتروژن را می پذیرد؟
اغلب کتاب ها این مطلب را طوری می نویسند که گویی آمونیاک جفت الکترون تنهای خود را به یون هیدروژن می دهد (یک پروتون تنها بدون هیچ الکترونی در اطراف آن).
این نظرات گمراه کننده اند 
این یون ها به قدری واکنش پذیرند که همیشه به ساختار دیگری متصل می شوند. اما . . .
از طرفی، در HCl اوربیتال خالی وجود ندارد که بتواند یک جفت الکترون بپذیرد. پس با این حساب آیا HCl یک اسید لوئیس است؟
کلر الکترونگاتیوتر از هیدروژن است و این به معنای آن است که کلرید هیدروژن یک مولکول قطبی خواهد بود. الکترون ها در پیوند کلر- هیدروژن به سمت کلر جذب خواهند شد و مختصری آن را منفی خواهند کرد و هیدروژن را با اندکی بار مثبت تنها خواهند گذاشت.

جفت الکترون تنها روی نیتروژن در مولکول آمونیاک به سمت اتم هیدروژن مولکول HCl با اندکی بار مثبت، جذب می شوند. هر چه این الکترون ها نزدیک می شوند، الکترون های پیوند کلر- هیدروژن باز هم به سمت کلر رانده می شوند.
در نهایت، یک پیوند کوئوردینانسی بین نیتروژن و هیدروژن تشکیل می شود و کلر به صورت یون کلر جدا می شود.
این مطلب با استفاده از " نمادگذاری خمیده" که معمولاً در مکانیسم های واکنشی آلی مورد استفاده قرار می گیرد، بهتر فهمیده می شود:
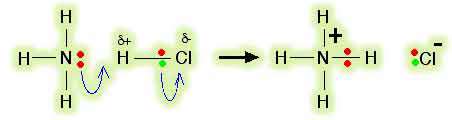
کل مولکول HCl نقش اسید لوئیس را دارد و یک جفت الکترون از آمونیاک می پذیرد و در حین واکنش، تفکیک می شود.
مرکز یادگیری سایت تبیان
تهیه: خدیجه آلچالانلو - تنظیم: یگانه داودی

















