
وسترن بلات 6
اهداف:
- آشنایی با الکتروفورز و سیستم SDS-PAGE
- آشنایی با مواد تشکیل دهنده ژل SDS-PAGE
- آشنایی با کمی سازی داده ای وسترن بلات
توضیح فیلم:
در ژل الکتروفورز دو بعدی مخلوط پروتئین ها درون ژل ریخته می شوند. این ژل دارای میزان PH کم با بالا است و پروتئین ها براساس خواص ایزومتریک در یک PH خاص می ایستند. این ژل روی غشای SDS قرار داده می شود و براساس وزن مولکولی در جایگاه صحیح قرار می گیرند.
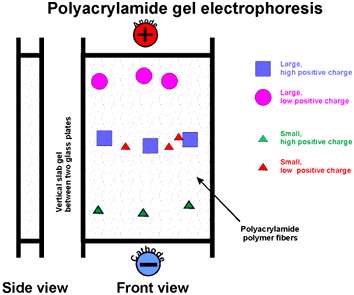
در این روش، ژل از پلیمرهای آکریلامید ساخته میشود که بیس-آکریلامید به صورت نوارهای عرضی این پلیمر را به طور منظم به هم ارتباط می دهد طوری که منافذ با قطر معین و یکسان در ژل ایجاد می شود. پلیمریزاسیون آکریل آمید و بیس آکریل آمید می تواند به صورت شیمیایی یا سیستم فتوشیمیایی باشد.
موارد زیر ازجمله موارد مهم در ساخت ژل مورد نیاز برای الکتروفورز می باشند.
اندازه منافذ ژل:
اندازه منافذ ژل هم با غلظت کل منومرهای آکریلامید در ژل و هم با نسبت بیس آکریلامید به آکریلامید مرتبط است.
غلظت کل آکریلامید (T):
اگر غلظت آکریلامید کمتر از 5/2 درصد باشد منافذ ژل بزرگ بوده و برای غربالگری مولکول های درشت با وزن مولکولی 1000 کیلودالتون مناسب می باشد.
نسبت بیس آکریلامید به آکریلامید( C):
از نظر تئوری هر قدر میزان بیس آکریلامید نسبت به آکریلامید بیشتر شود اتصال های عرضی بین پلیمری زیاد شده و اندازه منافذ کاهش می یابد.
انتخاب pH بافر:
در SDS-PAGE از 3pH تا 10 را می توان استفاده نمود و پروتئین پوشیده از SDS در هر حال دارای بار منفی است و حرکت خواهد داشت. در pH های بالاتر یا پایین تر از این محدوده هیدرولیز پروتئین ها اتفاق می افتد. اما وقتی پروتئین در حالت native (طبیعی) الکتروفورز می شود انتخاب pH خیلی مهم است.
آماده سازی نمونه ها برای بارگذاری روی ژل
1. نمونه های دناتوره و احیاء شده:
ساختار آنتی بادی به گونه ای است که قادر به شناسایی بخش های کوچکی از پروتئین می باشد. برخی از آنتی بادی ها، پروتیین هدف را تنها در حالت دناتوره شناسایی می کنند و برای اینکه این بخش از پروتئین برای آنتی بادی قابل دسترس باشد باید پروتئین را دناتوره کرده و به فرم خطی در آورد. فزون بر این، دناتوره کردن پروتئین ها باعث می شود از یک سو حرکت پروتئین ها در ژل و همچنین هنگام انتقال به بلات منظم و ساده تر گردد و از سوی دیگر پروتئین ها در وزن مولکولی مورد انتظار ایستاده و شناسایی آن آسان تر شود. برای دناتوره کردن پروتئین می توان در بافر بارگذاری از شوینده های آنیونی مثل SDS استفاده نموده و مخلوط پروتئینی را به مدت 5 دقیقه در دمای 95 درجه سانتی گراد حرارت داد.
2. نمونه های با ساختار طبیعی (Native) و احیاء نشده:
گاهی اوقات آنتی بادی بر علیه یک اپی توپ متشکل از اسیدهای آمینه غیر پیوسته از پروتئین می باشد، که در این حالت پروتئین باید به فرم سه بعدی بوده که قابل شناسایی توسط آنتی بادی باشد. برای حفظ ساختار سه بعدی، باید پروتئین را به صورت Native استفاده نموده و در تمام مراحل الکتروفورز از دناتوره شدن آن جلوگیری کرد.
کمی سازی وسترن بلات
یکی از کاربردهای متداول وسترن بلات عبارتست از بررسی کمی پروتئین مورد نظر بین نمونه های مختلف که خود به دو شیوه مطلق و نسبی اندازه گیری می شود. در روش مطلق با استفاده از استانداردی که مقدار دقیق پروتئین مورد نظر در آن تعیین شده است، می توان مقدار دقیق پروتئین را بر حسب نانو گرم و حتی پیکو گرم در نمونه مورد نظر به دست آورد.
در روش نسبی که در ادامه به آن بیشتر پرداخته می شود، هدف مقایسه نسبی میزان پروتئین در نمونه های بررسی شده است و معمولاً یکی از نمونه ها به عنوان استاندارد مقایسه در نظر گرفته شده و سایر نمونه ها با آن مقایسه می شوند تا اطلاعاتی کمی از میزان تغییرات بیان پروتئین در نمونه های مختلف به دست آید.
مرکز یادگیری سایت تبیان - تهیه: فاضل صحرانشین سامانی
تنظیم: مریم فروزان کیا

















