
آبکافت (1)

همان طور که گفته شد نمک ها بر اثر واکنش اسیدها و بازها به وجود می آیند. در واقع نمک فراورده ی واکنش خنثی شدن یک اسید توسط یک باز است.
امّا نمک حاصل از واکنش خنثی شدن، همیشه خنثی نیست. در این جا می خواهیم بررسی کنیم بعد از انحلال یک نمک اسیدی، بازی و یا خنثی در آب چه واکنش هایی صورت می گیرد.
تعریف آبکافت:
به واکنش یک یون با آب یا قسمتی از آب (OH- یا H3O+ یعنی) که طی آن اسید یا باز اولیه با بار الکتریکی کمتر حاصل شود، آبکافت می گویند.
ابتدا آبکافت یون های مثبت و منفی حاصل از یونش اسید یا باز را با ذکر قواعد و مثال بررسی می کنیم.
آبکافت یون های مثبت (کاتیون ها):
کاتیون مربوط به بازهای قوی (یعنی کاتیون فلزهای گروه 1 و 2 جدول تناوبی به جز Be2+ و Mg2+ ) آبکافت نمی شوند چون تمایلی برای جذب OH(aq)- ندارند. امّا کاتیون مربوط به بازهای ضعیف آبکافت می شوند و یون OH(aq)- را جذب می کنند.
هر چه باز ضعیف تر باشد شدت آبکافت کاتیون آن بیش تر خواهد بود.
به عنوان مثال Na(aq)+ با آب واکنش نمی دهد یعنی آبکافت نمی شود، زیرا کاتیون مربوط به یک باز قوی (NaOH) است. امّا CU(aq)+ که کاتیون یک باز ضعیف است آبکافت خواهد شد.
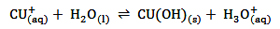
نکته: واکنش آبکافت در کاتیون های فلزی (CU+ مانند) به معنای جذب یون OH(aq)- است. امّا در مورد یون آمونیوم
(NH(4aq)+) واکنش آبکافت به معنای از دست دادن H+ است.
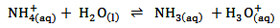
بر اثر آبکافت ها، غلظت H+ زیاد و در نتیجه PH محلول کم می شود.
- هر چه آبکافت کاتیون شدیدتر باشد، PH محلول کمتر می شود.
آبکافت یون های منفی (آنیون ها):
آنیون مربوط به اسیدهای قوی ( HSO4- و Br- , I- , CL- , CLO3- , NO3- , CLO4 های یون یعنی ) آبکافت نمی شوند چون تمایلی برای جذب H+ ندارند.
امّا آنیون مربوط به اسیدهای ضعیف آبکافت می شوند وH+ را جذب می کنند.
- هر چه یک اسید ضعیف تر باشد شدت آبکافت آنیون آن بیش تر است.
به عنوان مثال CL(aq)- آبکافت نمی شود چون آنیون یک اسید قوی (HCL) است. امّا CH3COO(aq)- یون استات (اتانوات) است که آنیون اسید ضعیف CH3COOH یا همان استیک اسید (اتانوئیک اسید) می باشد و آبکافت می شود.
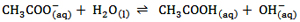
بر اثر آبکافت آنیون ها، غلظت OH- زیاد و در نتیجه PH محلول هم زیاد می شود.
- هر چه آبکافت آنیون شدیدتر باشد PH محلول بیش تر می شود.
نکته: هر چه بار منفی آنیون یک اسید بیش تر باشد نسبت به آنیون دیگر همان اسید (با بار منفی کمتر) بهتر آبکافت می شود.
آبکافت شدت: H2PO4- < HPO42- < PO43-
انواع نمک ها در آبکافت:
1- نمک خنثی (نمک اسید قوی و باز قوی): NaCL به صورت فیزیکی در آب حل می شود و یون های Na(aq)+ و
CL(aq)- را آزاد می کند. این یون ها به دلیل این که کاتیون و آنیون یک اسید قوی و یک باز قوی هستند آبکافت نمی شوند در نتیجه تغییری در PH آب صورت نگرفته و برابر 7 باقی می ماند. بنابراین این نمک خنثی است.
2- نمک اسیدی (نمک اسید قوی و باز ضعیف): NH4NO3 نمکی است که در اثر حل شدن در آب یون های
NH4(aq)+ و NO3(aq)- آزاد می کند. NH4(aq)+ کاتیون یک باز ضعیف و NO3(aq)- آنیون یک اسید قوی است. در نتیجه تنها NH4(aq)+ آبکافت می شود و یون های هیدروکسید را از محلول جذب کرده و PH را پایین می آورد. بنابراین این نمک اسیدی است.
3- نمک بازی (نمک باز قوی و اسید ضعیف): KF نمکی است که در اثر حل شدن در آب یون های K(aq)+ و F(aq)- را آزاد می کند. K(aq)+ کاتیون یک باز قوی و F(aq)- آنیون یک باز ضعیف است در نتیجه تنها F(aq)- آبکافت شده و یون های H+ را از محلول جذب می کند و PH را بالا می برد. بنابراین این نمک بازی است.
4- نمک اسید ضعیف و باز ضعیف: CH3COONH4 نمکی است که در اثر حل شدن در آب یون های NH4(aq)+ و
CH3COO(aq)- را آزاد می کند. این یون ها هر دو آبکافت می شوند چون کاتیون یک باز ضعیف و آنیون یک اسید ضعیف هستند. PH محلول به ثابت تفکیک اسید و باز بستگی دارد.

- Kb < Ka : محلول اسیدی
- Kb > Ka : محلول بازی
- Kb = Ka : محلول خنثی
نکته: اگر به آنیون نمک H+ و به کاتیون آن OH- اضافه کنید، با مقایسه قدرت اسید و باز ایجاد شده می توانید راحت تر اسیدی، بازی یا خنثی بودن نمک را تشخیص دهید. به عنوان مثال AgNO3 از یون های Ag(aq)+ و NO3(aq)- تشکیل شده با اضافه کردن OH- به Ag+ ، AgOH تشکیل می شود که یک باز ضعیف است. هم چنین با اضافه کردن H+ به NO3- ، HNO3 تشکیل می شود که یک اسید قوی است. ملاحظه می کنید که باز ضعیف و اسید قوی است در نتیجه نمک اسیدی می باشد.
سوال: کدام گزینه درست است؟
1- اسیدهای ضعیف آبکافت می شوند.
2- یون Mg2+ نسبت به یون Ca2+ بهتر آبکافت می شود.
3- بر اثر آبکافت یون NH4+ ، یون هیدروکسید تولید می شود.
4- یون Br- با آب واکنش می دهد و تولید HBr می کند.
مرکز یادگیری سایت تبیان – تهیه مهسا شاه حسینی


















